
서론
1906년 Tawara가 방실결절을 발견한 이후 1세기 동안 많은 연구가 진행되어 왔지만, 아직까지도 해부학 및 전기생리학적 특징이 확연히 밝혀진 것은 아니다. Zipes는 방실결절을 ‘심장의 영혼’이라고 표현하였고, 방실결절의 해부학적 구조와 전기생리학적 특징을 이해하면 심장 전체를 이해할 수 있다고 말하였으며, 아직까지도 잘 알려지지 않은 불가사의 속에 미스터리라고 말하였다.1 결국 이러한 표현은 방실결절이 심장에서 매우 중요한 역할을 하고 있으며, 구조적으로 또는 전기생리학적 특성이 매우 복잡하고 다양하다는
것을 말해 주고 있다. 그러나 최근 영상기기와 분자생물학 등의 진보, 특히 fluorescent imaging of voltage-dyes, 빛간섭단층 촬영(optical coherence tomography), molecular imaging with immunohistochemistry 등의 신기술들은 방실결절의 구조와 전기생리학적 특징을 밝히는 데 큰 기여를 하였다.
방실접합부
방실결절의 정의가 중요하며 가장 기본적인 사항임에도 불구하고 과거 임상가, 해부학자, 전기생리학자들은 방실결절을 각각 다르게 정의하여 사용하고 있었다. 방실결절을 compact node만으로, 또는 compact AV node와 주위 조직으로, 또는 atrial-His junction으로 간주할 수가 있다. Billette2는 방실접합부(atrioventricular junction)가 atrial-His interval에 기여하며, 심박수 의존성과 이중전도로(dual pathway)와 연관된다고 발표하였고, Dobrzinski등3은 posterior nodal extension에서 심박동기의 위치가 존재하는 것으로 발표한 것에 비추어
볼 때, Tawara4가 처음 말한 해부학적 방실결절, 즉 compact AV node가 아니라 atrial-His junction이 전기생리학적 방실결절이라고 말할 수 있다(Figure 1).
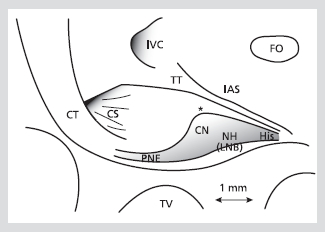
Figure 1. Bidimensional representation of the AV node with its landmarks. The location of the landmarks is shown on a scale as established from a magnified photograph of a rabbit heart preparation. Limits of the gray zone representing central nodal structures approximate those established from serial sagittal histologic sections. Asterisk marks the beginning of fibrous collar and enclosed node. Diffuse boundaries and marked overlapping between these structures are not represented. Reproduced with permission from
[2].
CN; compact node, CS; coronary sinus ostium, CT; crista terminalis, FO; foramen ovalis, His; His bundle, IAS; interatrial septum, IVC; inferior vena cava, NH; nodal-His bundle, PNE; ostial (posterior) nodal extension, TT; tendon of Todaro, TV; tricuspid valve
방실접합부의 구조와 기능
일반적으로 표면의 심내막은 심근이며, 밑으로 이행세포(transitional cell)들이 방실결절을 싸고 있다. 결절 자체는 세포 모양과 전체 구조의 모양을 기초로 하여 compact AV node와 lower nodal bundle로 구분되고, lower nodal bundle은 관상동맥구(coronary os)로 뻗어 posterior nodal extension을 형성하는데, 사람의 경우 rightward posterior nodal extension과 leftward posterior extension으로 나누어 질 수 있다(Figure 1, 2).5
기능적으로 방실결절은 활동전위(action potential) 모양의 이질성(heterogeneity)을 기준으로 N (nodal cell), NH (Nodo-His cell), AN (Atrionodal cell) 세포로 나누어 진다(Figure 3). N세포는 안정막 전위가 낮고, 활동전위의 높이가 낮으며, 활동전위 upstroke의 속도가 느리다. AN세포는 심방세포와 N세포의 전기생리학적 특징의 중간에 속하는 이행세포이다. N세포보다 안정막 전위는 높고, 활동전위의 upstroke는 크고 빠르다.
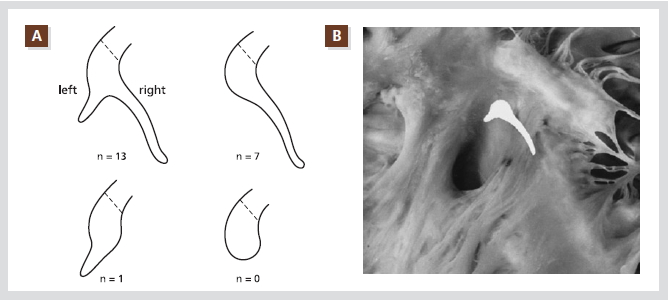
Figure 2. Schematic representation of posterior extensions of the compact AV node as encountered in this series of 21 randomly selected hearts. Note that none had a blunt-ending posterior end of the compact node. One case showed a leftward extension only; 7 showed a rightward extension only; and 13 showed both rightward and leftward extensions. The dotted lines indicate the site of transition between compact node and His bundle (A). The compact part of the AV node, together with the rightward and leftward posterior
extensions, are superimposed on the right-sided view of the AV septal junction of the same heart. The rightward posterior extension runs in close proximity to the annular attachment of the septal tricuspid valve leaflet and extends to the level of the os of the coronary sinus (B).
Reproduced with permission from [5].
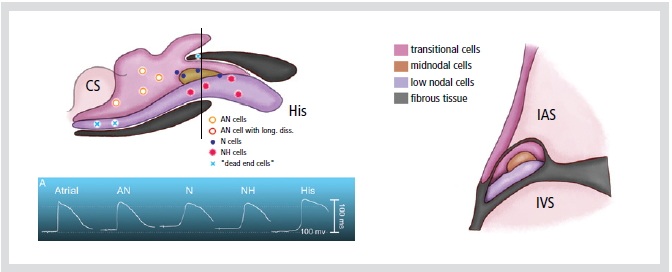
Figure 3. Diagram showing distribution of morphologically different cell types in rabbit AV node. Top: transverse section showing trilaminar appearance of anterior part of the node. Level of sectioning is indicated by a bar in the bottom panel. Bottom: diagram of AV node indication sites where typical transmembrane potentials were recorded (see sect. IIC; AN cell with long diss, recording of an action potential with double components, indicative of longitudinal dissociation).
CS; coronary sinus, His; his bundle,
IAS; interatrial septum, IVS; interventricular septum
NH세포의 경우 N세포와 히스속(His bundle) 세포의 전기생리학적 특징의 중간에 속하는 이행세포이다. N세포가 전형적인 N세포의 활동전위 모양을 나타내는 것은 아니나, 미소전극(microelectrode)과 조직 검사를 통하여 NH세포는 lower nodal cell과 일치하고, N세포는 주로 compact node에서 대부분이며, AN세포는 이행세포라는 것을 밝혔지만, 방실결절 활동전위 모양의 이질성은 이온 통로(ion-channel)의 밀도와 동역학의 이질성으로 기인하는 것 같다.6
방실접합부의 전기생리적 이질성의 분자생물학적 기초
방실접합부의 전기생리적 이질성은 이온 통로와 간극 결합(gap junction)의 이질성으로 기인하며, 다양한 활동전위 모양의 독특한 특징을 나타낸다. INa의 결핍과 L-type Ca2+currents (ICa, L)의 존재는 N세포 활동전위의 upstroke 속도가 느린 것과 관련이 있으며, 안정막 전위가 낮은 것은 HCN4의 존재와 inward-rectifier (IK1)의 부재로 설명된다. AN세포와 NH세포에서 활동전위 모양은 INa와 Ito의 존재와 관련이 있다. 심방과 심실, 방실결절에서의
이온 통로의 분포는 Figure 4와 같다.
지금까지 4개의 connexin (Cx)이 발견되어 왔는데, Cx40이 인간의 방실결절에서 풍부하게 발견되고, Cx45도 쥐, 생쥐, 토끼의 방실결절에서 발견되며, Cx31.9는 인간에서 발견되지 않는다. Cx43은 방실접합부에서 이질성으로 나타나는데, compact AV node와 leftward nodal extension에서는 나타나지 않으며, rightward nodal extension, lower nodal extension, 히스속에서는 많이 나타난다.
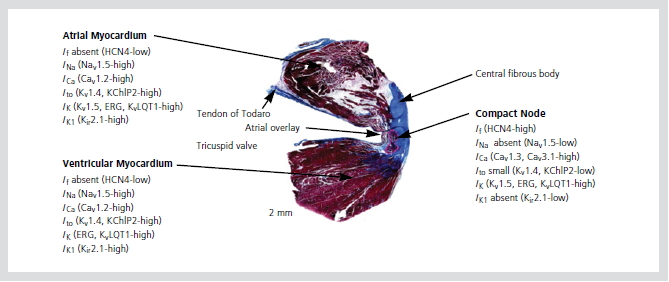
Figure 4. Ionic currents and ion channels in the atrioventricular Node.
Reproduced with permission from [12].
방실전도의 기전
방실결절 전도(AV nodal conduction)가 느린 이유에 관한 이론에는 Hoffman과 Cranefield7가 주장한 decremental conduction 이론과 Rosenblueth8가 주장한 step delay 이론이 있다. Decremental conduction 이론은 방실결절세포에서 심방과 심실의 세포와 달리 intracellular coupling이 감소되어 있고 INa가 감소되어 방실결절에서의 전도 속도가 느려지는 이론을 말하며, step delay 이론의 경우 특히 심방과 방실결절 사이에 장애물이 있어 이 위치에서 전도가 안되어 불연속 전도가 일어나 전도 속도가
느려지는 이론이다. Cx43의 경우 compact AV node에는 없고 이를 둘러싸고 있는 바로 옆의 이행세포에서 갑자기 많이 발견된다. 이러한 갑작스런 변화는 step delay 이론을 지지하는 한 증거가 될 수 있다.
이중전도로
Moe 등은 개 실험에서, Coumel 등은 인간에서, Jane 등은 토끼에서 조기 자극(premature stimulation)을 통하여 회귀를 유도하였고 이중전도로를 증명하였다. Optic mapping 도입 후 여러 부위에서 동시에 전기현상을 기록하므로 쉽게 방실결절의 이중전도로를 쉽게 증명할 수 있었다. 주로 토끼의 방실결절에서 쉽게 증명되어 왔고 완속전도로(slow pathway)는 inferior nodal extension에 있는 것으로 밝혀졌으나(Figure 5), 인간에서는 아직 방실접합부 빈맥에 포함된 기능적 회로의 해부학적 기질에 대하여 자세하게 밝혀져 있지
않다.
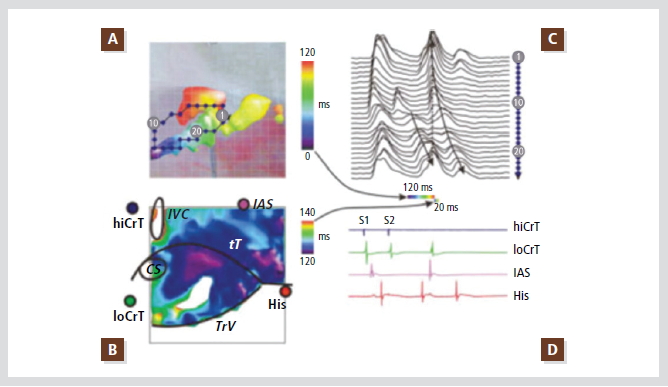
Figure 5. Typical (slow-fast) AV node reentry induced by premature stimulation of the Crista teminalis.
(A) Color map of conduction during reentry produced by a single premature impulse. Only first 120-msec interval of reentry is shown, illustrating activation of the posterior nodal extension, the compact AV node, and the fast pathway. Map is super-imposed with photograph of the preparation (see B for landmarks). Diamonds illustrate position of recording sites, optical signal from which are shown in C.
(B) Continuation of reentrant conduction: activation of the transitional AN layer in 20 msec. The same field of view is shown. Notice significant difference in activation times between the two panels.
(C) Optical action potentials recorded along the reentry pathway and fast pathway. Dashed-line arrow illustrates rapid conduction in the superficial transitional layer. Time scale bars below show time intervals illustrated in A and B as conduction maps.
(D) Conventional bipolar electrograms recorded during last basic stimulus (S1), premature stimulus (S2), and reentrant beat. Electrograms were recorded from high Crista terminalis (hiCrT), low Crista terminalis (loCrT), interatrial septum (IAS), and the bundle of His (His).
Reproduced with permission from [13].
방실접합부의 pacemaking activity
1903년 Engelmann은 방실결절이 밝혀지기도 전에 AV nodal rhythm을 묘사하였고, 1910년 Hering은 동결절(sinus node)을 파괴한 개와 토끼에서 AV 간격이 줄거나, 어떤 경우에는 사라지거나 또는 역전되는 현상을 발견하였다. 그는 전기가 방실결절의 상부에서 일어나면 AV 간격이 정상이고, 방실결절 중간에서 일어나면 AV 간격은 0이며, 방실결절 아래에서 일어나면 심실-심방 순으로 역전이 된다고 제안하였다. 그러나 후에 전기생리학자들은 방실결절 pacemaker로부터의 정방향, 역방향 전도 속도가 일정치 않으며, P파와 QRS파 사이의
관계에 영향을 미친다는 사실을 인식하였고, 방실접합부 pacemaker의 위치는 미스터리로 남아 있었다. 이후 1958년까지 처음으로 세포막 활동전위(trans-membrane action potential)가 토끼와 개의 방실결절에서 관찰될 때까지 특별한 발전은 없었다. 자발적인 이완기 탈분극(spontaneous diastolic depolarization)이 토끼 심장의 mid와 lower node에서 기록되었고, Hoffman, Cranefield 등은 방실결절의 pacemaker activity는 주로 NH세포와 히스속 지역에서 일어난다고 하였으나, 종종 다른 연구자들에 의한 반론도 있었다.
방실접합부 pacemaker의 위치를 알기 위한 방법의 어려운 점 중 하나는 기술적인 문제였다. 전기 현상의 이동을 mapping하는 것은 매우 어려운 것이었다. 그러나 형광염색을 이용한 optic mapping의 출현으로 매우 괄목적인 발전이 이루어 졌다. Efimov와 Dobrzynski 등3은 최초로 optic mapping을 이용하여 방실결절의 자동능(automaticity)을 연구하였고, 최근 토끼의 심장에서 방실결절 pacemaker의 위치는 대부분 posterior nodal extension에 위치하는 것으로 밝혔으며 특수 항체와 면역형광(immunofluorescent) 염색을 통하여 이곳을
방실결절로서 인식할 수 있게 되었다. 그러나 같은 그룹에서 심장 이식 시 적출한 인간 심장 두 개에서는 pacemaker의 위치가 히스속에서 관찰되었고, 개를 이용한 실험(Chen 등)에서 대부분이 compact node 근처에서 발견되어 방실결절의 pacemaker의 위치는 아직 논쟁 중이며, 또한 종마다 차이가 있을 가능성도 있다.
방실결절의 자율신경 지배
자율신경시스템은 방실전도 조절에 매우 중요하며, 과거 쥐와 기니아 피그의 실험을 통하여 자율신경시스템이 방실접합부에 매우 많이 분포하는 것으로 알려져 있다. Efimov 등9은 subthreshold stimulation (STS, 0.3-1 mA, 20 Hz, 1 min)을 통하여 자율신경을 자극하여 방실접합부 pacemaker의 반응을 보았다. 아무 약물 없이 STS를 한 경우 STS 동안 맥박수가 서서히 증가하고 중지 후에 일시적으로 좀 더 빠른 맥박수의 증가를 보인 후 다시 처음으로 돌아가게 되며, 부교감신경을 억제하는 atropine을 투약 후 STS를 하면 STS
동안 맥박수가 두 배로 증가하며 교감신경을 억제하는 nadolol을 투약 후 STS를 하면 맥박수의 감소를 보이게 된다.
방실결절 자동능의 기전
HCN4 통로를 통한 If current와 여러 가지 이온 통로(ICa- L, ICa-T, IST and various types of delayed rectifier K currents)들이 전통적인 pacemaker 기전인 ‘막 전압 시계(membrane clock)’이며, 현재 이러한 이온들이 방실결절의 자동능에 중요한 역할을 하는 것으로 사료된다. 그러나 최근 이러한 이온들 외에 동결절에서는 근소포체(sarcoplasmic reticulum)에서 리아노딘 수용체(ryanodine receptor)를 통하여 칼슘의 자발적인 분출이 나트륨-칼슘 교환에 의하여 pacemaker 기전(Ca
clock)에 중요한 역할을 하는 것으로 보이고 있다. 이러한 막 전압 시계와 칼슘시계(Ca clock)의 상호 작용이 동결절의 자동능 기전인 것으로 Lakatta 그룹10 및 Chen 그룹11에서 각각, 세포 및 조직 차원에서 증명되고 있다. 최근에는 Hancox 그룹에 의하여 방실결절에서 이러한 기전이 세포 차원에서 관찰되었고, 조직 차원에서도 Chen 그룹 등에 의하여 관찰되었다. 그러나 아직 이에 대해서는 논쟁 중이며 추후 좀 더 많은 연구가 필요하리라 생각된다.
결론
방실접합부는 심방과 심실 사이에 전기적 지연을 만들어 심방과 심실의 수축에 조화를 이룩하고, 동결절이 병적 상태에 처했을 때 pacemaker 역할을 할 수 있으며, 방실결절성 빈맥과 같은 많은 부정맥과 연관이 될 수도 있다. 미래에 이미지와 관련된 첨단 기기들의 발전과 분자 단계에서의 분석 방법의 발전은 방실접합부의 전기생리학적 특징을 완전히 밝혀 임상질환의 기전을 이해하는 데 큰 도움이 될 수 있을 것이다.
References
- Mazgalevn TN, Tchou P: Atrial-AV Nodal Electrophysiology: View from the Millenium. Armonk, NY: Futura Publishing, 2000.
- Billette J. What is the Atrioventricular node? Some clues in Sorting out its structure-function relationship. J Cardiovasc Electrophysiol. 2002;13:515-518.
- Dobrzynski H, Nikolski VP, Sambelashvili AT, Greener ID, Yamamoto M, Boyett MR, Efimov IR. Site of origin and molecular substrate of atrioventricular junctional rhythm in the rabbit heart. Circ Res. 2003;93:1102-1110.
- Tawara S. The conduction system of th mammalian heart. Translated by Kuzo S, Shimada M. London, UK: Imperial College Press;2000.
- Inoue S, Becker AE: Posterior extensions of the human compact atrioventricular node: A neglected anatomic feature of potential clinical significance. Circulation. 1998;97:188-193.
- Anserson RH, Durrer D, Janse MJ, Van Capelle FJL, Billete J, Becker AE, Durrer D. A combined morphological and electrophysiological study of the atriovnetricular node of the rabbit heart. Circ Res. 1974;35:909-922.
- Hoffman B, Cranefield P. Electrophysiology of the heart. New York: McGraw-Hill, 1960.
- Rosenblueth A. Mechanism of the Wenchebach-Luciani cycles. Am J Physiol. 1958;194:491-494.
- Hucker WJ, Nikloski VP, Efimove IR. Autonomoc control and innervations of the atrioventricular junctional pacemaker. Heart rhythm. 2007;4:1326-1335.
- Lakatta EG, Vinogradova T, Lyashkov A, Sirenko S, Zhu W, Ruknudin A, Maltsev VA. The integration of spontaneous intracellular Ca2+ cycling and surface membrane ion channel activation entrains normal automaticity in cells of the heart's pacemaker. Ann N Y Acad Sci. 2006;1080:178-206.
- Joung B, Tang L, Maruyama M, Han S, Chen Z, Stucky M, Jones LR, Fishbein MC, Weiss JN, Chen PS, Lin SF. Intracellular calcium dynamics and acceleration of sinus rhythm by betaadrenergic stimulation. Circulation. 2009;119:788-796.
- Zipes, Janife. Cardiac electrophysiology, fifth edition: From Cell to Bedside. pp252.
- Efimov IR. Structure-Function relationship in the AV junction. Anat Rec A Discov Mol Cell Evol Biol. 2004;280:952-965.
|