|
|
International Journal of Arrhythmia 2011;12(4): 24-29.
|

인공심박동기, 삽입형 제세동기 및 심장재동기화 치료를
위한 기구(cardiac rhythm device)는 pulse generator와
한 개 이상의 조율전극으로 구성되어 있다. 이들은 심외막 조율전극을 사용하기도 하나, 대부분은 심내막 조율전극을 이용하게 된다.
심외막 조율전극은 외과의사에 의해 시행되며,
대개는 조율전극의 안정성에 있어서 심내막 조율전극에 비해
문제가 많은 것으로 알려져 있다. 따라서 대부분의 경우 중심정맥을 통한 심내막 조율전극을 사용하며, 구조적 문제 또는
감염 등에 의해 심내막 조율전극을 사용하기 어려운 경우에
한하여 심외막 조율전극을 이용하게 된다. 본 저자는 심내막 조율전극을 이용한 삽입형 심박동 조절장치의 이식 방법에 대해서 논하고자 한다.
이식 전 환자의 준비
심실세동은 발생 후 심전도와 심실 수축 양상에 따라 총 4기로 분류한다.1 제 1기는 심실세동 발생 후 첫 1~2초간을 말하며 3~6번의 거의 정상에 가까운 심실 수축을 보인다.
대부분 입원하여 시행하게 되며, 시술 전 심전도, 혈액 검사, 흉부 방사선 검사 등을 시행하게 된다. 시술 6~8시간 전
부터 금식을 하게 되며 시술 부위와 같은 쪽의 상완 정맥에
정맥주사를 하는데, 이는 시술 중 적절한 정맥의 위치를 찾기
위해 조영제를 사용할 경우를 대비하기 위해서이다. 또한 시술 전 탈수가 되지 않게 적절한 수액을 투여하여야 한다.
특히 심장재동기화 치료를 위해 시술을 하는 경우에는 탈수가
되었을 때, 시술 중 저혈압을 경험하는 경우가 많으며, 수분
섭취가 많은 경우에는 장시간 누워서 시술을 받는 경우 심부전의 악화가 우려되므로 적절한 수액상태를 유지하는 것이
중요하다. 시술 전 복용하던 약물은 대부분 복용을 하게 하나, 심부전
환자의 경우 혈압을 강하시킬 수 있는 약물은 시술 당일 중단하고 시술하는 것이 필요할 수 있다. 항응고제를 복용하고 있
던 환자의 경우에는 다음과 같은 방법을 생각해 볼 수 있다.
시술 전 3~5일 동안 warfarin을 중단하고, conventional
heparin 또는 low molecular weight heparin으로 전환하여 투여하며, 그 후 conventional heparin은 시술 6시간
전, low molecular weight heparin의 경우에는 시술 24시간 전 중단한다. 시술 24시간 후 다시 warfarin과 함께
재투여하고, prothrombin time을 측정하여 INR 수치가
2.0 이상 되었을 때 warfarin 만으로 유지한다.1 다른 방법은 warfarin을 INR 수치 2.0~3.0 사이로 유지한 상태로
시술을 시행하는 것이다.
이 두 가지 방법은 최근 연구에서 전향적으로 비교되었으며, warfarin을 유지한 그룹에서 오히려 출혈과 관련된 합병증이 적은 경향을 보였다.2, 3, 4
다만, 항응고제 복용이 시술과
관련된 감염을 증가시킨다는 보고가 있어 이에 대해서는 주의가 필요하다.5
 Aspirin과 clopidogrel의 경우 aspirin만 단독으로 쓴
경우에는 항혈소판제를 사용하지 않았던 대조군과 비교하여
출혈 합병증의 유의한 차이가 없었으나, clopidogrel과 병합하여 사용했을 때는 출혈 합병증의 발생이 증가하였다.6
따라서 저자의 경우에는 시술 전 aspirin은 그대로 유지하고, clopidogrel은 적어도 5일 이상 중단하는 것을 원칙으로
한다. Warfarin을 사용하는 경우에는 INR 수치가 therapeutic range를 유지한 상태로 이식하고 있으며,
시술 도중에도 특별히 출혈의 정도가 심하다고 느낀 적은 없었다. 그러나 clopidogrel의 경우에는 시술 도중 출혈 경향이
눈에 띄게 관찰된다.
시술 전 예방적 항생제는 반드시 투여하는 것이 필요하다.
Device implantation은 안전한 시술이기 때문에 최근에
예방적 항생제를 사용하지 않은 군과 전향적으로 비교한 연구가 있었으며, 예방적 항생제를 사용하지 않은 군에서
device와 관련한 감염률이 증가하였다는 사실을 보고하였다.7 대개 1세대 cephalosporin을 시술 직전에 사용하게
된다.
Aspirin과 clopidogrel의 경우 aspirin만 단독으로 쓴
경우에는 항혈소판제를 사용하지 않았던 대조군과 비교하여
출혈 합병증의 유의한 차이가 없었으나, clopidogrel과 병합하여 사용했을 때는 출혈 합병증의 발생이 증가하였다.6
따라서 저자의 경우에는 시술 전 aspirin은 그대로 유지하고, clopidogrel은 적어도 5일 이상 중단하는 것을 원칙으로
한다. Warfarin을 사용하는 경우에는 INR 수치가 therapeutic range를 유지한 상태로 이식하고 있으며,
시술 도중에도 특별히 출혈의 정도가 심하다고 느낀 적은 없었다. 그러나 clopidogrel의 경우에는 시술 도중 출혈 경향이
눈에 띄게 관찰된다.
시술 전 예방적 항생제는 반드시 투여하는 것이 필요하다.
Device implantation은 안전한 시술이기 때문에 최근에
예방적 항생제를 사용하지 않은 군과 전향적으로 비교한 연구가 있었으며, 예방적 항생제를 사용하지 않은 군에서
device와 관련한 감염률이 증가하였다는 사실을 보고하였다.7 대개 1세대 cephalosporin을 시술 직전에 사용하게
된다.
이식 시술 과정(implant procedure)
1. 시술 부위
시술 부위의 선택은 일반적으로 좌측 쇄골하 부위를 선택하게 된다. 그러나 왼손을 주로 사용하는 환자에게는
우측 쇄골하 부위를 선택할 수 있다. 그러나 삽입형 제세동기의 경우에는 왼쪽 쇄골하 부위에 can을 위치시키는 것이 제세동 역치(defibrillation threshold, DFT)를 줄일 수 있는 것으로
알려져 있으므로,8,9 가능한 왼쪽에 위치시키도록 한다.
2. Generator pocket
피부를 절개한 후에 피하 지방 아래까지 박리한다. 근육을
감싸고 있는 근막(fascia)이 보이면 그 층을 따라 박리한다.
Pocket을 만들 때 주의해야 할 점은 device를 삽입하는데
필요한 공간보다 적어도 1.5배 이상 크게 박리를 하여야 한다는 것이다. 여유가 없이 빡빡하게 device를 삽입하게 되면, 시술 후에 통증을 느끼는 경우가 많으며, 또한 후에
pressure necrosis에 의한 pocket erosion이 발생할 수
있다(Figure 1).
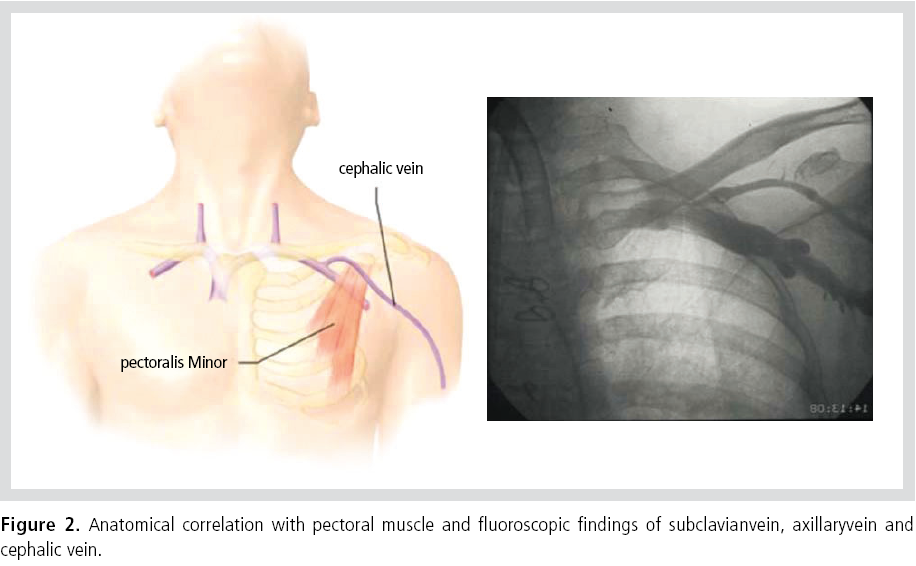
3. 정맥의 접근
정맥 접근은 주로 쇄골하정맥(subclavian vein)을 이용하는 경우가 많으나, 겨드랑정맥(axillary vein), 노쪽피부정맥(cephalic vein)을 이용하기도 한다(Figure 2).
1) 쇄골하정맥
쇄골하정맥은 비교적 해부학적 구조가 일정하여 쉽게 찾을 수 있는 장점이 있다. 하지만, 쇄골과 늑골 사이의 공간이
좁아 조율전극의 손상이 쉽게 올 수 있으며, 폐와의 거리가
가까워 천자 도중 기흉의 발생이 있을 수 있다. 따라서 가능한 천자 방향은 외측으로 하는 것이 필요하다.
2) 겨드랑정맥
겨드랑정맥은 흉곽 바깥에 위치하므로 기흉 등의 위험성이 없는 장점이 있다. 하지만 주행 경로가 일정하지 않아 쇄골하정맥에 비하여 천자하기가 쉽지 않은 경우가 많다.
따라서 대부분의 경우 같은 방향의 상박정맥에 조영제를 투여하여 fluoroscopy상 위치를 확인하면서 천자하는 경우가 많
다. 경험이 쌓이면 fluoroscopy상 첫 번재 늑골을 보고 천자하거나, 노쪽피부정맥의 위치를 보고 천자할 수 있다.
3) 노쪽피부정맥
대개 cut down 방법을 사용하여야 한다. 또한 혈관의 크기가 작아 여러 개의 조율전극도자를 삽입하는 것이 힘들 수
있다. 겨드랑정맥과 마찬가지로 흉곽 바깥에 위치하므로 기흉의 위험성이 없으며, 혈관이 직접 보이기 때문에 여러 번
천자할 필요가 없어 익숙해 지면 시간을 절약할 수 있다.10
4. 조율전극의 위치
1) 심방전극의 위치
심방전극의 경우 안정성을 위하여 우심방이(right atrial
appendage)에 위치시킨 것이 일반적이다. 다만, 우심방 하부 중격 또는 Bachman’s bundle에 위치시켰을 때, 심방세동의 발생을 줄이고, 혈류역학을 증가시킨다는 보고가
있으나 아직 일반적이지는 않으며 논란이 있다.11, 12, 13
2) 심실전극의 위치
전통적으로 우심실은 우심실 첨부에 위치시켰다. 하지만, 우심실 첨부에 의한 심실 조율이 심부전, 좌심실 부전의 발생 및
심방세동의 발생도 증가시키는 원인으로서 지목됨에 따라14, 15, 16, 17, 18
최근에는 우심실 첨부를 제외한 우심실의 다른 부위에 심실전극을 위치하는 것에 대한 연구가 진행되었다. His
bundle, 우심실 유출로, 심실 중격 등이 대안으로서 제시되고 있으나, 적절한 우심실 전극의 위치에 대해서는 아직 많은
논란이 있다. 현재 fluoroscopy와 심전도를 이용하여 우심실 유출로의 중격쪽에 조율전극을 위치시키는 방법은 Hary
Mond에 의해 기술되었으며,19 아직은 장기적 효과에 대한
논란이 있다.
심장재동기화 치료를 위한 좌심실 전극의 위치에 대해서는 여러 가지 제한점이 있다. 우선 coronary sinus의 해부학적 구조에 의해 제한을 받게 된다. 또한 해부학적 구조가
적절한 분지를 이용하여 위치시킨 후에도 가로막 신경
(phrenic nerve) 자극에 의해 횡격막을 자극할 수 있다. 따라서 좌심실 전극을 위치시킨 후에 device가 가지는 최대치의
전류량으로 횡격막 자극이 오는지를 점검하여야 하고, 횡격막 자극이 있다면, 다른 분지를 찾아서 전극을 위치시키는
것이 최선의 방법이다. 만약 그것이 가능하지 않다면, LV
pacing polarity를 바꾸거나, pulse amplitude를 낮추고
pulse width를 늘리는 것도 대안이 될 수 있다. active
fixation lead를 사용하거나, quadripolar 전극을 사용하여 프로그래밍하는 것을 고려할 수 있으나, 현재 우리나라에서는 사용할 수 없는 실정이다.

이식과 관련된 합병증
대부분의 환자가 절개 부위에 약간의 통증을 호소하고, 반상 출혈이 있을 수 있다. 또한 혈종(hematoma)이 발생할
수 있는데, 이는 대부분 clopidogrel을 복용하였거나,
heparin 또는 low molecular weight heparin을 시술 후
다시 시작하였을 때 발생하는 경우가 많다. 이식 후에 발생하는 가장 중요한 합병증은 시술 부위 또는 전극에 발생하는 감염이다. 이들 감염이 의심되었을 때는 우선
혈액 배양을 시행하여 혈류를 통하여 동정되는 균이 있는지를 확인하는 게 중요하며, 경식도 초음파를 시행하여 심장 판막 및 조율전극에
vegetation이 있는 지를 확인하는 것이 필요하다. 혈액에
동정되는 균이 있을 시에는 전체 system을 제거하여야 한다. 제거 후에도 지속적으로 항생제를 사용해야 하며, 심장판막에 vegetation이 있었던 경우에는 혈액 배양에 균이
동정되지 않은 상태에서 2주 후에 다시 이식하는 것이 권장된다(Figure 3).20
감염의 연관 인자는 여러 가지이나, 이식 당시 주의해야
하는 것은 시술 직전 항생제를 사용하고, 조기에 전극 이탈에
의한 재시술을 피해야한다. 또한 혈종이 발생되지 않게 해야하고, 시술 시간을 가능한 줄이는 정도이다. 최근 device를
감싸는 antibiotic envelope가 개발되어 사용되고 있으나,
아직 장기간 사용 연구가 보고되지는 않았다.21
References
- Michaud GF, Pelosi F, Jr., Noble MD, Knight BP, Morady F,
Strickberger SA. A randomized trial comparing heparin initiation
6 h or 24 h after pacemaker or defibrillator implantation.
J Am Coll Cardiol.
2000;35:1915-1918.
- Cheng A, Nazarian S, Brinker JA, et al. Continuation of warfarin during pacemaker or implantable cardioverter-defibrillator implantation: a randomized clinical trial.
Heart Rhythm.
2011;8:536-540.
- Giudici MC, Paul DL, Bontu P, Barold SS. Pacemaker and implantable cardioverter defibrillator implantation without reversal of warfarin therapy.
Pacing Clin Electrophysiol : PACE.
2004;27:358-360.
- Tolosana JM, Berne P, Mont L, Heras M, Berruezo A,
Monteagudo J, Tamborero D, Benito B, Brugada J. Preparation
for pacemaker or implantable cardiac defibrillator implants in
patients with high risk of thrombo-embolic events: oral
anticoagulation or bridging with intravenous heparin? A
prospective randomized trial.
Eur Heart J.
2009;30:1880-1884.
- Lekkerkerker JC, van Nieuwkoop C, Trines SA, et al. Risk factors and time delay associated with cardiac device infections: Leiden device registry.
Heart.
2009;95:715-720.
- Tompkins C, Cheng A, Dalal D, Brinker JA, Leng CT, Marine JE,
Nazarian S, Spragg DD, Sinha S, Halperin H, Tomaselli GF, Berger
RD, Calkins H, Henrikson CA. Dual antiplatelet therapy and
heparin “bridging” significantly increase the risk of bleeding
complications after pacemaker or implantable cardioverterdefibrillator
device implantation.
J Am Coll Cardiol.
2010;55:2376-2382.
- de Oliveira JC, Martinelli M, Nishioka SADO, et al. Efficacy of Antibiotic Prophylaxis Before the Implantation of Pacemakers and Cardioverter-Defibrillators.
Circulation: Arrhythmia and Electrophysiology.
2009;2:29-34.
- Gold MR, Shih HT, Herre J, Breiter D, Zhang Y, Schwartz M. Comparison of defibrillation efficacy and survival associated with right versus left pectoral placement for implantable defibrillators.
Am J Cardiol.
2007;100:243-246.
- Roberts PR, Allen S, Betts T, Morgan JM, Urban JF, Whitman T,
Euler DE, Kallok MJ. Increased Defibrillation Threshold with
Right-sided Active Pectoral Can.
J Interv Card Electrophysiol.
2000;4:245-249.
- Ussen B, Dhillon PS, Anderson L, Beeton IAN, Hickman M, Gallagher MM. Safety and Feasibility of Cephalic Venous Access for Cardiac Resynchronization Device Implantation.
Pacing Clin Electrophysiol.
2011;34:365-369.
- Bailin SJ, Adler S, Giudici M. Prevention of chronic atrial fibrillation by pacing in the region of Bachmann's bundle: results of a multicenter randomized trial.
Cardiovasc Electrophysiol.
2001;12:912-917.
- Hermida J-S, Kubala M, Lescure F-X, et al. Atrial septal pacing to prevent atrial fibrillation in patients with sinus node dysfunction: Results of a randomized controlled study.
Am Heart J.
2004;148:312-317.
- Wang M, Siu C-W, Lee KL, et al. Effects of right low atrial septal vs. right atrial appendage pacing on atrial mechanical function and dyssynchrony in patients with sinus node dysfunction and paroxysmal atrial fibrillation.
Europace.
2011;13:1268-1274.
- Sweeney MO, Hellkamp AS. Heart failure during cardiac pacing.
Circulation.
2006;113:2082-2088.
- Sweeney MO, Hellkamp AS, Ellenbogen KA, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction.
Circulation.
2003;107:2932-2937.
- Tantengco MV, Thomas RL, Karpawich PP. Left ventricular dysfunction after long-term right ventricular apical pacing in the young.
J Am Coll Cardiol.
2001;37:2093-2100.
- Thambo JB, Bordachar P, Garrigue S, Lafitte S, Sanders P, Reuter S, Girardot R, Crepin D, Reant P, Roudaut R, Jais P, Haissaguerre M, Clementy J, Jimenez M.
Detrimental ventricular remodeling in patients with congenital complete heart block and chronic right ventricular apical pacing.
Circulation.
2004;110:3766-3772.
- Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia
H, Kutalek SP, Sharma A; Dual Chamber and VVI Implantable
Defibrillator Trial Investigators. Dual-chamber pacing or
ventricular backup pacing in patients with an implantable
defibrillator: the Dual Chamber and VVI Implantable Defibrillator
(DAVID) Trial.
JAMA : the journal of the American Medical
Association.
2002;288:3115-3123.
- Mond HG, Hillock RJ, Stevenson IH, McGavigan AD. The right ventricular outflow tract: the road to septal pacing.
Pacing Clin Electrophysiol.
2007;30:482-491.
- Baddour LM, Epstein AE, Erickson CC, Knight BP, Levison ME, Lockhart PB, Masoudi FA, Okum EJ, Wilson WR, Beerman LB, Bolger AF, Estes NA 3rd, Gewitz M, Newburger JW, Schron EB, Taubert KA; American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee; Council on Cardiovascular Disease in Young; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Nursing; Council on Clinical Cardiology; Interdisciplinary Council on Quality of Care; American Heart Association.
Update on Cardiovascular Implantable Electronic Device Infections and Their Management.
Circulation.
2010;121:458-477.
- Bloom HL, Constantin L, Dan D, De Lurgio DB, El-Chami M, Ganz LI, Gleed KJ, Hackett FK, Kanuru NK, Lerner DJ, Rasekh A, Simons GR, Sogade FO, Sohail MR; COoperative Multicenter study Monitoring a CIED ANtimicrobial Device Investigators. Implantation Success and Infection in Cardiovascular Implantable Electronic Device Procedures Utilizing an Antibacterial Envelope.
Pacing Clin Electrophysiol.
2011;34:133-142.
|
|
|
|