2018 심방세동 카테테 절제술 대한민국 진료지침: Part III
2018 Korean Guidelines for Catheter Ablation of Atrial Fibrillation: Part III
Article information
Trans Abstract
Catheter ablation of atrial fibrillation (AF) is one of the most complex interventional electrophysiological procedures. The success of AF ablation is based in large part on freedom from AF recurrence based on electrocardiography (ECG) monitoring. Arrhythmia monitoring can be performed with the use of noncontinuous or continuous ECG monitoring tools. AF ablation is an invasive procedure that entails risks, most of which are present during the acute procedural period. However, complications can also occur in the weeks or months following ablation. Recognizing common symptoms after AF ablation and distinguishing those that require urgent evaluation and referral to an electrophysiologist is an important part of follow-up after AF ablation. This section reviews the complications associated with catheter ablation procedures performed to treat AF. The types and incidence of complications are presented, their mechanisms are explored, and the optimal approach to prevention and treatment is discussed. Finally, surgical and hybrid AF ablation technology and the indications for concomitant open or closed surgical ablation of AF, stand-alone and hybrid surgical ablation of AF are covered in this section.
I. 심방세동 절제술 후 추적 관찰 시 고려할 점들
심방세동의 카테터 절제술 후 첫 달에 발생할 수 있는 합병증의 모니터링
심방세동의 카테터 절제술은 시술 중 급성 합병증이 발생할 수 있는 침습적인 시술이며, 카테터 절제술 이후 수 주에서 수개월이 경과한 후에도 합병증이 발생할 수 있다[1-3].
심방세동의 카테터 절제술 후 발생할 수 있는 흔한 증상들과 심한 합병증을 감별하는 것은 매우 중요하다. 합병증은 카테터 절제술 후 1달 이내에 발생하는 것1과 1달 이후에 발생하는 것으로 분류할 수 있다.
심방세동의 카테터 절제술 후 1달 이내에 발생하는 합병증의 증상과 징후
표1에 카테터 절제술 후 수 개월 이내에 발생할 수 있는 증상과 징후들을 정리해두었다. 이 증상과 징후들은 시술 후 30일 이내에 발생하는 것과 30일 이후에 발생하는 것으로 분류하였다. 감별진단 해야 할 질환이나, 진단을 위해 필요한 검사도 표1에 나타내었다. 전신마취를 하고 심방세동의 카테터 절제술을 진행한 경우, 몇몇 환자들은 시술 후 며칠동안 피로감을 느낄 수 있다. 기도삽관이나 경식도심초음파 검사에 의하여 목이 쉬거나, 음식물을 삼킬 때 통증을 호소할 수 있으며, 이것들은 시간이 지나면 호전된다. 혈관 천자부위의 압통도 흔하게 나타난다. 천자부위에 출혈이 있었던 경우에는, 중력에 따라 멍든 부분이 아래로 퍼지게 된다. 만약 동정맥루나 가성동맥류가 의심되는 경우에는 즉시 초음파를 시행하여야 한다. 시술 도중 오랫동안 누운 자세를 유지하기 때문에, 등과 엉덩이의 통증을 호소할 수 있다. 그러나, 통증이 아주 심하거나 옆구리에도 멍든 부분이 보일 경우, 후복막에 혈종이 발생하였을 가능성이 있으므로 즉시 컴퓨터 단층촬영이 필요하다. 다리로 출혈이 많이 된 경우에는 구획증후군이 발생할 수 있다. 심방세동의 카테터 절제술 후 몇 가지 이유로 호흡곤란을 호소할 수 있다. 시술 중 관류카테터로 인해 수액이 많이 주입될 수 있기 때문에, 체액 과다의 소견이 있는지 평가해보고 필요할 경우 이뇨제를 사용할 수 있다. 체액 과다가 없음에도 불구하고 호흡곤란을 호소할 경우에는 흉부단순방사선 사진을 촬영하여 감염의 징후 또는 한쪽 횡격막의 상승 등이 있는지 확인해야 한다. 횡격막 신경의 손상은 냉각풍선 절제술을 시행하였을 경우에 더 많이 발생하지만, 고주파 카테터 절제술 후에도 발생할 수 있다[4]. 방사선 투시 중 흡기를 하게 하여서 횡격막의 움직임이 없는 경우 횡격막 신경손상을 진단할 수 있다. 우횡격막 신경 손상이 발생하는 경우가 좌측에 비해 흔한데, 이는 우상폐정맥이나 상대정맥과 우횡격막 신경이 가깝게 위치하기 때문에, 그 주변을 카테터 절제하다가 우횡격막 신경이 손상을 받기 쉽다. 대부분의 횡격막 신경 손상은 6에서 12개월 안에 신경섬유가 재분포하면서 자연히 호전되지만, 영구적인 횡격막 마비도 보고되었다. 시술 후 흉통을 호소하는 경우도 흔하며, 심낭염, 관상동맥 허혈, 근육통 등의 원인으로 나타날 수 있다. 그 중 심낭염이 가장 흔하며 (~75%) 길게는 1주일 정도 통증이 지속된다. 심낭염 증상이 일주일 이상 지속되거나 호흡곤란 등의 증상이 동반되는 경우에는 추가적인 검사가 필요하다. 카테터 절제술 후 조직의 부종이 일어나기 때문에 거의 대부분의 환자에서 약간의 심낭삼출액은 관찰된다. 증상조절을 위해 비스테로이드성 소염진통제를 사용할 수 있고, 콜히친도 사용할 수 있다. 경구 스테로이드 제제는, 증상이 잘 조절되지 않거나 재발성이지 않은 한 사용하지 않는 것이 좋다. 흉통이 심근 허혈을 시사하는 심전도의 변화를 동반하거나, 노작성 흉통인 경우, 특히 고주파 절제술을 관상정맥동 내부에 시행했거나, 승모판막 협부의 심외막 부분에 시행한 경우, 좌회선관상동맥의 손상 가능성을 고려해야 한다[5].
저혈압이 발생한 경우, 우선 심초음파 검사를 통해 심낭삼출액으로 인한 문제는 아닌지 신속히 감별해야 하며, 총혈구 혈액 검사를 시행하여 감염이나 출혈여부를 확인해야 한다. 방광 내 도뇨관 삽입과 관련된 감염이나, 기도삽관과 관련된 폐렴여부도 확인해야 한다. 심낭염도 미열을 일으킬 수 있다. 또한, 심방식도누공이 발생할 때 첫 번째 징후가 발열로 나타날 수 있다. 만약 발열이 지속되거나 심방식도누공을 배제할 수 없을 때에는 흉부 영상 검사를 시행해야 한다. 카테터 절제술 후 발생하는 신경학적 증상은 뇌 영상 검사를 시행하여 뇌 색전증 여부를 감별해야 한다. 편두통 증상도 발생할 수 있으며, 대부분 심방중격천자에 의하여 생긴 심방중격결손이 남아있어서 발생하는 증상으로 생각된다. 대퇴부 통증이 7일 이상 지속되거나 점차 심해지는 경우에는 즉시 신체검진 및 혈관초음파를 통해 대퇴부 혈관 천자부위의 가성동맥류나 동정맥루 등의 합병증의 발생 여부를 배제하여야 한다. 마른 기침이 6주까지 발생할 수 있으며, 냉각풍선 절제술을 받은 환자에서 더 흔하게 발생한다. 기관지 신경이나 폐의 직접적인 손상이 원인으로 생각된다. 보통 대증적인 치료로 4에서 6주에 걸쳐 호전된다[6,7].
객혈은 드물지만 폐렴이나 폐정맥 폐쇄로 인한 폐경색 때문에 발생할 수 있으며, 이는 카테터절제술 후 3~6개월에 주로 발생한다. 카테터 절제술 후 며칠간 연하곤란이 발생할 수 있으며, 경식도심초음파검사나 기도삽관에 의한 자극이 원인으로 생각된다. 연하곤란이 지속적인 경우, 영상검사를 통해 심방식도누공 형성 여부를 배제해야 한다. 좌심방의 후벽에 광범위한 절제술을 시행한 경우, 식도나 위로 분포하는 미주신경의 손상이 발생할 수 있다[8-10]. 이로 인해 오심 및 조기 포만감 등의 증상이 나타날 수 있다. 식사를 소량으로 자주 먹도록 권장하는 것이 좋으며, 증상은 4~6주에 걸쳐 호전되는 것이 일반적이다. 카테터 절제술 후 초기에 QT연장과 함께 다형성 심실빈맥이 발생하였던 국내의 증례 보고가 있으나, 이것은 매우 드물다[11].
심방세동의 카테터 절제술 후 1달 이후에 발생하는 합병증의 증상과 징후
연하곤란 및 발열, 특히 위장관 출혈이나 신경학적 증후를 동반하는 경우에는 신속히 심방식도누공 여부를 검사해야 하며, 이는 사망률이 높은 합병증이므로 주의해야 한다[12-15]. 만일 심방식도누공이 의심된다면, 위내시경은 시행해서는 안된다. 내시경으로 인해 높아진 식도 압력으로 인해 공기가 좌심방으로 들어가 뇌경색을 일으킬 수 있기 때문이다. 컴퓨터 단층촬영이나 자기공명영상을 시행하여 종격동이나 좌심방 내에 공기를 발견하면 진단할 수 있다. 바륨은 식도 내로 주입해서는 절대 안되지만, 수용성 조영제를 소량 식도에 주입하는 것은 누공의 위치를 찾는데 도움을 준다. 심방식도누공에 대해 권장되는 치료는 수술적으로 누공을 절제하는 것인데, 이는 누공이 있는 식도 부위를 절제하고 좌심방 후벽을 심낭패치로 재건하는 과정을 필요로 한다. 심방식도누공을 초기에 식도스텐트로 치료한 증례보고 및 심낭식도누공을 심낭배액관 삽입으로 치료한 증례보고가 있으나[16], 수술적 치료가 일반적으로 선호된다. 카테터 절제술 6주 이후까지도 기침이 지속되는 경우, 특히 흉통이나 재발성 폐렴, 객혈이 동반되는 경우에는 폐정맥 협착이 발생한 것은 아닌지 흉부전산화 단층 촬영 등의 검사가 필요하다[17-20]. 흉부단순방사선 사진에서는 전형적으로 폐의 한 엽에만 국한된 무기폐나 침윤이 보일 수 있으며, 이는 국소적 폐부종에 의한 것이다. 폐정맥 협착이 발견되면, 호흡-관류 스캔을 시행하여 폐의 관류를 확인해야 한다. 폐정맥 스텐트 삽입에 경험이 풍부한 전문가에게 조기에 의뢰하는 것이 좋다. 협착이 심해질수록 확장시키기 어려우며 폐 고혈압, 폐경색, 객혈 등 합병증의 발생률이 높아지기 때문이다.
카테터 절제술 전/후의 심전도 모니터링
심전도 모니터링은 부정맥의 카테터 절제술의 대상이 되는 환자들의 초기 평가에 매우 중요한 부분이다. 카테터 절제술 시행 전에, 환자의 증상이 확실히 심방세동에 의한 증상인지 여부 및 발작성 심방세동인지 지속성 심방세동인지 여부를 확인하는 것이 중요하다. 카테터 절제술 술기의 선택 및 예상되는 예후, 항응고 치료 전략, 경식도심초음파 시행 여부 등 많은 부분이, 이 결과에 영향을 받을 수 있기 때문이다. 시술 전 심전도 모니터링을 통해 심방세동의 유발요인이 될 수 있는 상심실성 빈맥이 있는지, 또는 빈번한 심방 조기수축(24시간에 1,000개 이상)과 비지속성 심방빈맥이 국소적 유발 요인이 되는지 여부도 확인할 수 있다[21]. 국소적 심방세동은 폐정맥 내에서 심방세동을 유발시키는 국소적 유발요인으로 인해 발생하는 특징이 있다[22]. 이런 유발 요인들이 발견된다면, 제한적으로 이들에 대한 절제술만 (상심실성 빈맥 또는 일부 폐정맥) 시행하는 것이 적절하다고 생각된다[21]. 심부전이 있는 환자는 빈맥-유발성 심근병증일 수 있기 때문에, 맥박수 조절이 적절하게 되고 있는지 심전도 모니터링을 통해 평가하는 것이 특히 중요하다[25].
카테터 절제술 후에도 심전도 모니터링은 매우 중요한 역할을 한다. 심방세동 카테터 절제술 후 3개월간은 심방세동의 조기재발의 확률이 높다[26,27]. 그렇기 때문에, 카테터 절제술의 효과를 판정하기 위한 심전도 모니터링은 시술 후 최소 3개월 이후에 시행하는 것이 보통이다. 그러나, 한달 이후의 조기재발은 후기재발의 강한 예측인자이다. 따라서, 이 기간의 심전도 모니터링을 통해 추후 2차 카테터 절제술이 필요하거나 항부정맥제 사용이 필요한 대상을 발견하는 데 도움이 될 수 있다[28-32].
카테터 절제술 후 심전도를 모니터 하는 것은, 환자에게 적절한 치료를 하기 위한 목적과 함께 임상 연구의 한 부분으로써도 중요하다. 임상적인 측면에서 볼 때, 환자가 두근거림의 재발을 호소할 경우, 이것이 심방세동의 재발 때문인지 아니면 다른 심방빈맥이 있는지의 여부를 감별할 때 유용하다. 환자는 심실 조기수축이나 심방 조기수축이 있을 때도 자주 두근거림을 호소하기 때문에, 두근거림의 재발이 심방세동의 재발을 의미하는 것은 아니다[33,34].
심전도 모니터링은 무증상인 환자에서도 카테터 절제술 후 항응고치료의 지속이나 중단과 같은 임상적 결정을 내릴 때에 유용한 참고자료가 된다. 카테터 절제술 후 심방세동이 재발하여도 무증상인 환자들이 많다는 것은 익히 알려져 있다[33-40]. 심전도 모니터링을 통해 무증상인 심방세동 재발을 발견하는 것은 심방세동 카테터 절제술 후 효과를 판정하는 임상연구에 반드시 포함되어야 하는 중요한 부분이다.
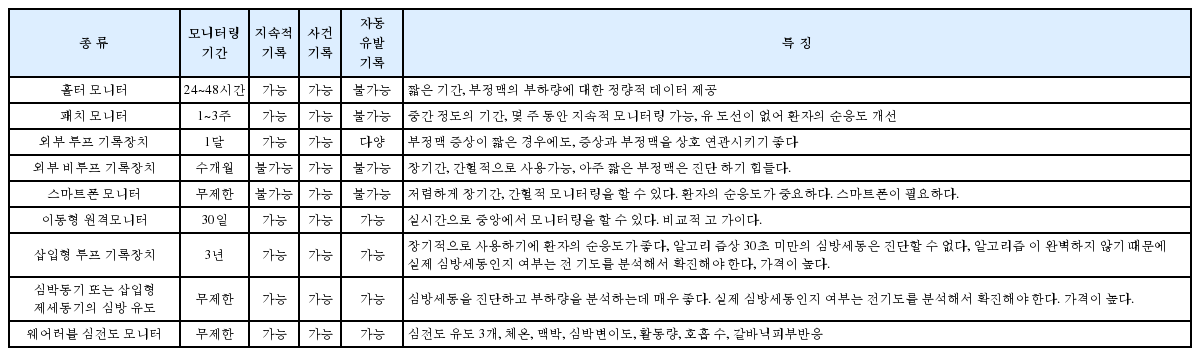
부정맥을 모니터링하기 위해 현재 사용 가능한 방법들
심전도 모니터링은 심방세동 카테터 절제술의 성공여부를 평가하는데 중요한 도구이다. 그리고 모니터의 결과에 의해 임상진료 및 임상연구의 결과에 큰 영향을 받는다. 심전도 모니터링은 크게 지속적 심전도 모니터링과 비지속적 심전도 모니터링으로 분류할 수 있다(표2). 각각의 방법을 선택하는 것은, 개개인의 특성, 예상되는 부정맥의 특성에 따라 달라진다. 모니터링을 더 철저히 할수록 심방세동의 발견확률은 증가한다[33,36,37,41-47]. 카테터 절제술 전의 환자들에서는 무증상의 심방세동 사건 발생 비율이 11~35%이고, 카테터 절제술 후의 환자에서는 무증상 심방세동 사건의 비율이 53~65%라고 보고된 바 있다[48-50]. 다른 연구에서는 동율동을 유지하는 환자에서, 53.8%의 심방세동 사건이 무증상이었다고 보고하고 있으며, 카테터 절제술 후 시간이 오래 지날수록 무증상의 심방세동 사건이 증가한다고 하였다. 따라서, 증상만으로는 심방세동 카테터 절제술의 성공 여부를 판단하기는 힘들다[34]. 간헐적 모니터링을 통해 심방세동을 발견해내는 것은 심방세동의 부하량과 관련이 있으며, 모니터링을 자주, 그리고 길게 할수록 심방세동을 발견할 확률이 높아진다[43,51-53]. 반면에, 모니터링 방법이 복잡하고 길어질수록, 환자의 순응도는 떨어진다. 전통적으로, 심방세동 카테터 절제술 후 모니터링 방법으로는 일정간격 및 증상이 있을 때 심전도, 홀터 모니터, 체외형 루프 기록장치, 원격 기록장치 등이 사용되었다. 최근에는 삽입형 루프 기록기와 스마트폰 앱을 이용한 무선 모니터링 장비가 개발되어 사용되고 있다.
홀터 모니터는 한 개 또는 여러 개의 리드를 가진 외부 기록장치로, 두세 개의 채널을 24시간에서 48시간 기록할 수 있다. 환자는 증상을 일기에 기록하거나 버튼을 눌러서 사건을 기록할 수 있다. 홀터 모니터는 숙련된 기사에 의해 분석되고 경험이 풍부한 의사가 판독하기 때문에 표준 모니터 방법으로 생각된다. 이벤트 루프 레코더는 일반적으로 몇 주 또는 몇 개월 이상 장기 모니터링에 사용할 수 있다[54]. 비루프 외부 이벤트 레코더는 증상이 발생한 경우 환자가 전극을 가슴이나 손 등에 부착하여 기록하는 방식이다. 최근에는 스마트 폰 기반의 심전도 모니터가 개발되고 있으며, 이는 장기적인 심전도 모니터에 유용하다[55,56]. 심방세동 카테터 절제 후 실시 된 한 연구에서, 스마트 폰 기반의 심전도 모니터링 장치는 심방세동을 진단하는데 100%의 민감도와 97%의 특이도를 보여주었다[56].
삽입형 루프 모니터는 한번 삽입 후 3년까지 사용할 수 있으며, R-R 간격 분석을 기반으로 지속적인 심방세동 모니터링을 할 수 있다[57,58]. 삽입형 루프 모니터는 수술 또는 카테터 심방세동 절제술의 결과를 평가하기 위해 여러 연구에서 사용되었고 유용성이 증명 된 바 있다[37,58-68]. 삽입형 루프 모니터는 장기적으로 심방세동 부하량의 결정에 유용하다. 심방세동 검출 알고리즘은 주로 RR 간격의 규칙성을 기반으로 하는데, QRS 파형을 감지할 때 민감도나 특이도의 문제로 진단에 착오가 있을 수 있어 숙련된 인력의 확인이 필요하고, 이벤트 수가 너무 많을 때에는 메모리의 한계로 인해 오래된 사건기록부터 순차적으로 덮어쓰기를 하게 되므로 정기적인 확인이 필요하다[45,46,69]. 그럼에도 불구하고, 이식 가능한 연속 모니터는 환자의 순응도 문제를 해결할 수 있고, 항응고제의 계속 사용 여부에 영향을 미칠 수 있는 무증상의 심방세동 에피소드 및 심방세동 부하량 등을 평가할 수 있는 장점이 있다. 외과적 심방세동 절제 후 시행되었던 한 연구에서는 기존의 홀터 모니터링과 비교하여 삽입형 루프 기록장치를 갖고 있는 환자군이 추적관찰 중 항부정맥제/심율동 전환술/심방세동 카테터 절제술 등을 더 많이 받게 되고 결과적으로 1년 이후 동율동 유지 확률이 더 높다고 보고하였다[44].
영구형 심장 박동기 및 이식형 제세동기는 모드-변환 에피소드의 수와 지속 시간을 추적하여 심방세동의 부하량을 평가할 수 있다[70,71]. 이 장치는 또한 장기간의 심방세동 부하량과 이의 변화 경향, 무증상 재발을 평가 할 수 있다[42,72,73]. 이 장치들은 심방 내 심전도를 기록할 수 있기 때문에 심방 부정맥의 진단에 탁월한 민감도와 특이도를 갖고 있다[36,74,75].
정기적인 임상 추적 및 모니터링 지침
임상 시험에 등록되었는지 여부에 관계없이 심방세동의 카테터 절제술을 받는 모든 환자는 절제술 후 최소 3 개월 동안 절제술 받은 기관에서 추적 관찰을 하는 것이 일반적이다. 또한 그 이후에도 지속적으로 의사에 의해 정기적인 관찰이 필요하다. 이러한 지속적인 경과관찰로 심방세동의 존재 유무와 뇌졸중 위험 정도 및 항응고 치료 필요성을 포함하여 환자의 임상 상태를 평가할 수 있다. 이러한 추적관찰은 또한 관련된 질병 및 생활 습관 개선의 치료에 중점을 둘 기회를 제공한다. 심방세동 카테터 절제술을 받은 모든 환자는 최소 3개월에 1회 이상 추적관찰을 받고 이후 2년 동안은 최소 6개월에 1회 이상 추적관찰을 하는 것이 권장된다. 매번의 추적 관찰시 마다 12리드 심전도를 시행하는 것이 권장된다[76]. 비만, 수면 무호흡 및 고혈압과 같은 심장 위험 인자가 심방세동의 발달 및 진행을 유도하는 기질을 형성하는 심방의 구조적 및 전기적 재형성과 관련된다는 연구 결과가 많이 축적되어 있다. 따라서 추적관찰 하면서 리듬 자체만 모니터링하는 것이 아니라 관련 질병 및 생활 습관을 평가하고 치료할 수 있다.
절제술 후 조기 재발
정의와 재발률
심방세동 절제술 후 조기 재발은 처음 3개월 안에 심방세동이 30초 이상 재발 하였을 때로 정의된다. 후기 재발은 심방세동 절제술 후 3개월에서 12개월 사이에 발생한 30초 이상의 심방부정맥 재발로 정의된다[77-79]. 심방세동의 조기 재발에서 의미하는 재발은 심방조동 및 심방빈맥의 재발도 포함된다. 카테터 절제술 후 심방세동의 조기 재발은 심방세동 절제술의 첫 3개월 이내에 환자의 50%까지 보고되었다[27,28,80-83]. 이러한 조기재발이 장기간에 걸친 치료 실패를 명확하게 나타내지는 못하기 때문에 (이 환자 중 절반만 후기 재발을 나타낸다), 이 기간은 공백기간 또는 치료 안정기간이라고 한다[28,84]. 그러나, 조기재발은 후기재발의 예측인자이며, 3개월 이내라 할 지라도 더 늦은 시점에 심방세동의 재발이 관찰될수록 장기적 성공률은 더 낮다고 알려져 있다[28,83].
재발의 원인들
이러한 조기 재발의 병태 생리학적 메커니즘은 다양한 기전들에 기인한다: 주로 폐정맥의 불완전한 격리[84,85], 절제술에 의한 급성 염증 반응[86], 격리되었던 폐정맥에 전기전도의 재발[87]. 자율신경계의 변화, 심방의 기질의 변화, 고주파 절제술의 지연성 효과 등이 그 기전으로 제시되고 있다.
시술 실패의 예측인자로써 조기재발의 역할
절제 직후의 조기재발의 발생은 추후 추적 관찰 중에 치료 실패를 나타내는 것은 아니다[22]. 그럼에도 불구하고 조기 재발은 일부 환자에서 카테터 절제술 후 부정맥 재발을 예측하는 것으로 나타났다[83,88-90]. 조기 재발에 대한 관리는 논쟁의 여지가 있으며 항부정맥제, 부신피질 스테로이드, 초기 심장 율동 전환 또는 반복 카테터 절제로 치료되었다.
항부정맥제
초기 심방세동 재발은 대개 폐정맥 격리술 이후 처음 몇 주 내에 최고조에 달하기 때문에 잠재적인 예방 전략으로 절제술 직후 기간에 항부정맥제를 사용하는 방안을 사용하는 경우도 있다[91]. 이 접근법의 유용성 여부는 아직 논란이 있지만, 일시적인 항부정맥제 사용이 후기 부정맥 재발을 예방하지 못한다는 연구 결과가 있다[28]. 이 연구에서 항부정맥제 치료군은, 6주간의 치료 기간 동안 임상적으로 의미 있는 심방성 부정맥, 심율동 전환술 시행률 및 부정맥 관련 입원률이 유의하게 낮은 것으로 나타났다 (항부정맥제군 13% 대 비-항부정제군 28%; p<.05); 그러나 6 개월 후 심방세동 재발의 차이는 없었다 (72% 대 68%) [92]. 따라서, 심방세동 후 항부정맥제의 사용 또는 중단 여부는 장기적 재발률에 영향을 주지 못한다고 생각된다.
부신피질 스테로이드 약제
심방세동 재발과 고주파-유발성 염증과의 연관성을 고려할 때, 고용량 부신피질 스테로이드를 사용한 경험적 사전 치료는 조기 심방세동 재발 및 장기 재발의 발생률을 감소시킬 수 있다고 생각되었다. 한 연구에서는 증상이 있는 심방세동에 대하여 폐정맥 격리술을 시행 받은 125명의 환자군에서 이 가설을 조사했다[93]. 부신피질 스테로이드 요법은 72시간내의 즉각적인 재발률을 현저하게 감소시킴(7% 대 31%, 부신피질 스테로이드군 대 위약군)으로써 1개월 째 초기 심방세동 재발률을 현저히 감소(27% 대 49%,) 시켰으며, 14개월 째 항부정맥 약제 없이 동율동이 유지될 확률도 부신피질 스테로이드 그룹에서 유의하게 높았다 (85% 대 14%). 조기 및 후기 재발을 예방하기 위해 부신피질 스테로이드의 효능을 평가하기 위한 또 다른 연구가 최근에 발표되었다. 저자들은 무작위로 두 그룹 (스테로이드 그룹 및 대조군)에 배정된 138명의 환자들을 분석하였다. 주요결과 변수는 심방세동의 조기재발 (시술 후 3개월 이내) 이었다. 이 기간 동안 138명 중 51명 (37.0%)의 환자가 심방세동 절제술 후 조기재발을 경험했다. 스테로이드 군은 대조군보다 조기재발의 비율이 낮았다 (64명 중 15명 (23.4%) 대 74명 중 36명 (48.6%), P=0.003). 그러나, 24개월의 추적 관찰 기간 동안 후기 재발의 발생률은 2 그룹 사이에 차이가 없었다 (로그 랭크 테스트, P=0.918). 다변량 분석에서 단기 스테로이드 치료는 낮은 심방세동의 조기 재발률과 관련이 있었다(조정 교차비 0.45, 95% CI 0.25-0.83, p=0.01). 국내에서 발표된 3건의 연구에서도, 부신피질 스테로이드 치료가 중기~후기의 재발을 낮춰주지는 못하였다[94-96]. 따라서, 시술주변기에 단시간 중등도 강도 스테로이드 요법이 조기 재발을 감소시킬 수 있으나, 늦은(3-24 개월) 심방세동 재발을 예방하는 데는 효과적이지 않다고 생각된다[97]. 부신피질 스테로이드의 최적의 용량 및 치료 후 안전성과 내약성에 대한 연구도 부족한 실정이다.
콜히친
소염제인 콜히친은 심방세동 시술 후에 심낭염과 관련된 통증을 줄이기 위해 사용되었지만 심방세동의 재발을 줄이기 위한 목적으로도 사용되었다. 콜히친은 심장 수술 후 심방세동을 감소시키는 것으로 나타났으며[98], 심방세동 카테터 절제술 후에도 연구되었다. 첫 번째 주요 연구는 발작성 심방세동의 카테터 절제술을 받은 161명의 환자에서 시행된 전향적 무작위 시험이었다. 환자는 무작위로 하루 2회 콜히친 0.5mg 또는 위약을 투여 받았다[99]. 3개월의 추적관찰에서 심방세동은 위약 환자의 34%에서 발생하였고, 콜히친 치료 환자의 16%에서 재발했다. 콜히친은 C-반응성 단백질과 IL-6을 감소시켰다. 다른 연구에서 발작성 심방세동 환자 233명을 대상으로 무작위 연구를 실시한 결과 콜히친 치료 환자의 장기 재발률은 31% 였고 위약 환자는 49%였다. 그러나, 콜히친의 효과에 대해서는 아직 논란이 있으며, 미국에서 심방세동 카테터 절제술 지침 제정위원들을 대상으로 한 설문 조사에 따르면, 그 중 6 %는 퇴원 후 1-3개월 동안 콜히친을 일상적으로 투약하지만, 94%는 일상적으로 콜히친을 사용하지 않았다.
전기적 심율동 전환술
3 건의 연구에서 고주파 카테터 절제술 후 조기 재발로 인해 심장 율동 전환을 필요로 하였던 환자의 장기 결과를 조사했다. 한 연구에서 심방세동 절제술 후 2.7±1.4개월에 전기적 심율동 전환술을 시행 한 55 명의 환자를 조사했다[100]. 평균 15±8개월을 추적관찰 한 결과, 15%는 항부정맥제 없이 동율동이 잘 유지되고 있었고, 20%는 심방세동의 부하량이 90% 이상 감소하였으며, 65%는 심방세동이 재발하였다. 이 연구에서는 전기적 심율동 전환술의 시행 타이밍과 후기 재발율 사이에 관계는 없는 것으로 나타났다[100]. 다른 연구에서는 심방세동 절제술 후 전기적 심율동 전환술이 필요했던 93명을 분석하였다[101]. 평균 16개월의 추적관찰 후, 27%의 환자들은 항부정맥 제 없이 동율동이 유지되고 있었다. 앞서의 연구와 달리, 이 연구에서는 부정맥 재발 후 1달 이내에 조기 전기적 심율동 전환술을 시행한 경우가, 그렇지 않은 경우보다 동율동 유지 확률이 20배 이상 높았다. 전기적 심율동 전환술을 한달 이상 지연시킨 경우, 4% 만이 항부정맥 약제 없이 동율동을 유지하였다. 다변량 분석에서, 부정맥의 재발에서 전기적 심율동 전환술 시행까지 걸린 기간이, 동율동 유지의 유일한 독립적 예측인자였다. 심방세동 절제술 후 전기적 심율동 전환술이 필요했던 515명을 분석한 더 큰 연구에서는[102], 심방부정맥이 재발하면 24시간 이내에 심장 율동 전환을 목표로 즉각적인 전기 심장 율동 전환이 수행되었다. 초기 90일 이내에 전기적 심율동 전환술을 받았던 환자의 대부분(75.6%)은 1년 째 까지 동율동이 잘 유지되고 있었다. 90일에서 180일 사이에 전기적 심율동 전환술을 받은 환자는 48%가 1년째 동율동이 유지되었다. 따라서, 절제 후 조기(3개월 이내)에 전기적 심율동 전환술을 받은 환자가 동율동 유지 확률이 더 높은 것으로 나타났다.
심방세동 카테터 절제술 후 재발한 경우 전기 심율동 전환술을 적극적으로 조기에 시행하는 접근 방식은 후기 부정맥 재발을 최소화하고 만성 항부정맥제 사용을 줄이며 재시술을 방지하고 동율동을 유지하는데 유용한 것으로 보인다. 수술적 심방세동 절제술을 받은 환자들에서도 아미오다론에 추가하여 적극적인 전기적 심율동 전환술을 시행 받은 군이 동율동 유지 확률이 높다고 보고되었다[103]. 따라서, 심방세동 절제술 후 지속성 심방세동으로 재발한 경우, 30일 이내에 전기적 심율동 전환술을 시행하는 것이 현재 권장되고 있다. 그렇지만 이를 뒷받침하기 위한 임상적 데이터는 아직 제한적이다. 심방세동의 재발을 치료하기 위해 필요한 전기적 심율동 전환술의 횟수에 관한 연구가 발표된 바 있다[104,105]. 40명의 환자를 대상으로 한 이 소규모 임상시험에서 전기적 심율동 전환술을 3회 이상 받은 경우에는 절제술의 실패와 관련이 있었다. 따라서 현재로서는, 2회의 전기적 심율동 전환술 후에도 재발하는 경우에는 절제술을 재시행하는 것을 고려하라고 권장되고 있다.
조기 재절제술 시행
초기에 재절제술을 시행한 경우에는 추가적인 심방세동 재발의 발병률을 줄이지만, 환자가 받는 전체 시술의 수는 더 많아진다. 2건의 연구에서 심방세동 조기재발 환자에서 조기 재절제술 시행의 효과를 평가하였다[77-79,102,106]. 고주파 절제술을 시행 한 302명의 환자들에서, 151명은 심방세동의 조기재발을 경험했으며, 그 중 61명은 첫 달에 심방세동 카테터 절제술을 재시행 받았다. 나머지 90명은 첫 심방세동 절제술 후 적어도 1개월 이후에 재시술을 받았다. 11개월의 평균 추적 관찰 기간 동안 조기 재절제술을 받은 환자는 재발율이 낮았으며 (51% 대 91%, p<.0001), 증상이 호전되었고 삶의 질이 향상되었다. 그러나, 전체 추적 기간 동안 요구된 총 시술의 수는 조기 재절제술을 받은 환자에서 더 많았다(2.5±0.7회 대 2.2±0.6회, p=0.02) [106]. 조기 재절제술 시행이 임상적으로 심방세동의 재발률을 줄여주는 효과가 있으나, 시술 후 한 달 이내에 시행하는 것이 시기적으로 적절한지는 불확실하다. 첫 달에 심방세동의 재발을 경험한 환자 중에서 많게는 60%까지는 장기적으로 추적관찰을 하여도 더 이상 심방세동의 재발을 보이지 않는다고 보고되고 있다[107]. 따라서, 심방세동의 조기재발은 일시적인 현상일 수 있으므로, 이 시기에 조기 재절제술을 시행하는 것은 권장되지 않는다[108].
결론
이론적으로, 심방세동의 조기 재발을 적극적으로 치료하면 전기적 및 구조적 재형성을 방지하고 장기적인 결과를 개선할 수 있다. 심방세동 조기재발에 대한 최적의 관리를 명확히 하기 위해서는 보다 신뢰할 수 있는 추적 방법을 사용하는 대규모 연구가 필요하다.
심방세동 절제술 후 발생하는 심방 빈맥
새로 발생하는 심방 빈맥은 심방세동 카테터 절제술 후 관찰되는 모든 부정맥의 50%를 차지한다[109-116]. 대부분의 이러한 빈맥은 좌심방에서 발생하지만, 우심방의 정맥-삼첨판 협부 의존성 심방 조동도 발생할 수 있다. 심방빈맥이 발생하게 되면, 시술전의 심방세동에 비하여 심실 박동 속도가 더 빨라지기 때문에 (보통 2대 1 전도), 시술 전보다 증상이 더 악화되었다고 호소할 수 있다. 이러한 경우 항부정맥제로 동율동 전환하기도 어려운 경우가 많다. 좌심방 빈맥의 기전으로는, 폐정맥 격리술 시행부분이 재연결되어 미세 회귀가 형성되거나, 절제술로 인해 생긴 심방내 흉터 주변으로 거대 회귀가 형성되어 심방 빈맥이 발생할 수 있다[112].
심방세동 절제술 후 3개월 이내에 조기 심방빈맥이 발생한 경우, 후기 심방빈맥 또는 심방세동이 발생할 확률이 증가한다[117-119]. 그러나 조기 심방빈맥의 49%까지도 시간이 경과함에 따라 해결되기 때문에, 증상이 잘 조절된다면 조기 재시술을 시행해서는 안된다. 초기 치료에는 전기 심율동 전환 및 항부정맥제를 사용한다. Vaughan Williams Class Ic 항부정맥제는 전도 속도를 느리게 하여 거대 회귀로 인한 빈맥을 유발할 수 있기 때문에, class III 항부정맥제 (소타롤, 아미오다론)이 일반적으로 선호된다. 증상이 심하여 잘 조절되지 않거나, 3개월 이후에도 심방빈맥이 지속되는 경우, 재시술을 시행하면 90%에서 효과적으로 카테터 절제할 수 있다[120-122].
후기 재절제시술
상당수의 환자에서, 첫 심방세동 절제술 후 심방세동이나 심방빈맥의 후기 재발이 발견된다[123-129]. 최근의 데이터에 따르면, 추적 기간과 환자 특성에 따라 15%에서 50% 사이의 환자가 재시술을 받는다고 한다[130]. 심방세동 절제술 후 첫 2-3개월 동안 심방세동/심방빈맥의 조기 재발은 꽤 흔하며, 시간의 경과에 따라 자발적으로 호전될 수도 있으므로 가능하면 재시술은 3개월 이후로 연기해야 한다. 또한 일부 환자들은 항부정맥제나 맥박수 조절 약물로 조절이 잘 되지 않으며, 이러한 경우 첫 3개월 이내라 할지라도 재시술을 시행하면 증상이 잘 조절될 수 있는 경우도 있다. 대부분의 연구에서는 시술 후 재발하는 경우에는, 외부의 새로운 부정맥 유발 부위보다는 이전에 격리된 폐정맥의 전기 전도가 재개되어서 발생한다고 보고했다[131]. 그러나, 반복적인 재시술(예:두 번째 이상의 재시술)에서는 다른 기전이 더 중요한 역할을 하는 것으로 생각된다[132]. 결과적으로, 두 번째 심방세동 절제술을 시행 할 때 첫 번째 단계는 각 폐정맥에서 전기 활동의 재연결이 있는지를 확인하는 것이다. 재연결이 발견되면 절제시술의 첫번째 목표는 폐정맥을 재격리하는 것이다. 그러나 폐정맥 재연결의 증거가 없다면 최상의 절제 기법에 대한 결정은 더욱 복잡하다[133]. 좌심방 기질 지도화 분석 및 이에 따른 맞춤형 절제술, 복합 분획 심방 전기도(CFE, complex fractionated atrial electrogram)의 절제, 상대정맥과 같은 비폐정맥 유발요인의 절제 등이 사용될 수 있다. 그러나 어떠한 방법이 최적의 방법인가에 대한 확실한 증거는 부족하다[134,135].
자율 신경계의 변화
심방세동 절제술의 잠재적인 부작용으로는 자율 신경 활동의 일시적인 변화와 영구적인 변화가 있다. 심박수의 과도한 상승, 부적절한 동성 빈맥 및 심박수 변화의 감소가 폐정맥 격리술 이후에 관찰되었다[136]. 다른 사람들은 폐정맥 격리술 후 맥박수의 감속 및 가속 능력과 같은 자율 기능이 즉각적으로 감소한다고 보고했다. 이러한 변화 중 일부는 1년 이상 지속될 수 있다[134,137]. 폐정맥 격리술과 관련된 대부분의 자율 신경계 변화는 일시적이며, 중대한 증상과 관련이 없지만, 심혈관계 미주 신경 손상의 경우 심각한 자율 신경계 변화가 발생할 수 있다[138-141]. 한 전향적 관측 연구에서 심방세동 절제술 후 식도 운동성의 일시적 장애 (6개월 이내)가 새로 발생할 확률이 매우 높다(33%-48%)고 보고하였다[142]. 대부분의 환자가 몇 개월 내에 회복되지만 드물게 수술 후 28개월 이상 위장 장애가 지속될 수 있다. 또 다른 연구에서는 고출력 (25-30W)으로 좌심방 후벽을 절제 시술한 후 위장 장애가 7.9%에서 발생하는 것으로 나타났다. 절제 라인이 식도를 가로 지르는 지점에서 출력을 20-25W로 줄이면 식도 운동성저하 합병증을 줄일 수 있다고 보고되었다[141]. 절제 중에 사용되는 출력에 추가하여, 절제 시간과 접촉력도 식도주변 미주 신경 손상을 결정하는 요인일 수 있다. 요약하면, 심방세동 절제시술과 관련된 대부분의 자율신경계 변화는 무증상이며 시간의 경과에 따라 자가 호전되었다. 그러나 좌심방 후벽에 대한 절제술 후에는 중증의 미주신경 손상이 발생할 수 있으므로 주의가 필요하다.
지연성 재발 (심방세동 절제술 1년 이상 경과 후)
많은 연구자들이 성공적인 심방세동 절제술 후에도 지연성 심방세동 재발이 길게는 10년 후까지 발생하는 것으로 보고하였다[143-145]. 최근의 메타 분석에 따르면, 19건의 연구에 포함된 6,167명의 환자를 3년 이상 추적 관찰한 결과를 분석한 결과, 심방세동 재발 없이 잘 유지되는 경우는, 단일 시술 후 53%, 여러 번 반복해서 시술 받은 환자에서는 80%로 보고 되었다. 심방세동 절제시술 1년 후 정상 동율동이 잘 유지되는 환자들에서도, 이후 매년 심방세동 재발률이 7.6%로 추정되어 5년 및 10년에 각각 16-46% 및 30-54%의 재발률을 보였다. 흥미롭게도, 재발률은 높지만 심방세동의 진행률(발작성 심방세동에서 지속적 심방세동으로, 0.3%) 및 뇌졸중 발생률(1%)은 매우 낮은 것으로 보고되었다. 또한 재발까지의 시간이 결과에 영향을 미칠 수 있다는 사실도 주목해야 한다. 지연성 재발 환자는 발작적 심방세동으로 재발될 확률이 높으며 항부정맥제 및 반복적인 절제술에 대한 반응이 초기 재발 환자보다 더 좋다. 지연성 재발에 대한 가장 일관된 예측 인자는 시술 전에 지속적 심방세동이었는지 여부이다. 다른 예측 인자로는 고혈압, 나이, 좌심방 크기, 당뇨병, 판막 심장 질환 및 좌심실 기능 장애, 높은 혈전 색전증 위험 점수, 대사증후군 등이 있다[146,147].
반복적인 절제술이 필요하게 된 환자의 경우, 심방세동의 재발은 주로 폐정맥의 재연결로 인한 것으로 나타났다. 그러나 폐정맥이 아닌 다른 부분 또는 이전 절제선에 전기적 틈새도 중요한 원인이 될 수 있다. 특히, 좌심방이와 좌심방의 후벽은 지속성 심방세동 환자에서 유의한 유발요인을 포함하는 것으로 나타났으며, 이 부분에 대한 격리 시술은 장기적 결과를 개선하는데 도움이 될 가능성이 제기되고 있다.
II. 결과 및 효과
개요
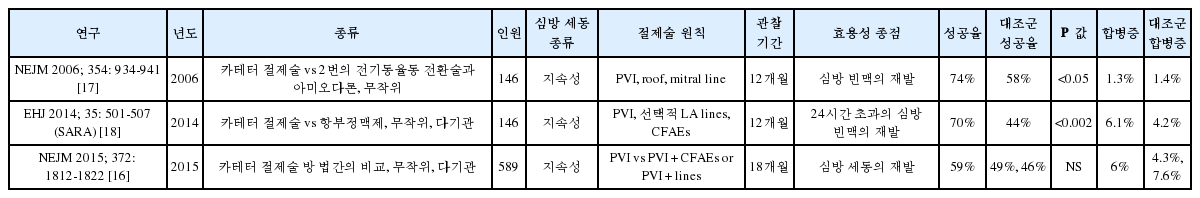
최근 10년간 심방세동 절제술에 대한 많은 무작위 연구들이 수행되었고 그 중 많은 연구가 카테터 절제술과 항부정맥제 치료를 1차 치료로 비교한 연구이다. 그 이외에도 카테터 절제술의 기술적인 방법이나, 카테터 절제술을 심박수 조절과 비교한 연구들이다. 표에서 심방세동 절제술의 결과에 대한 연구들을 정리하였다.
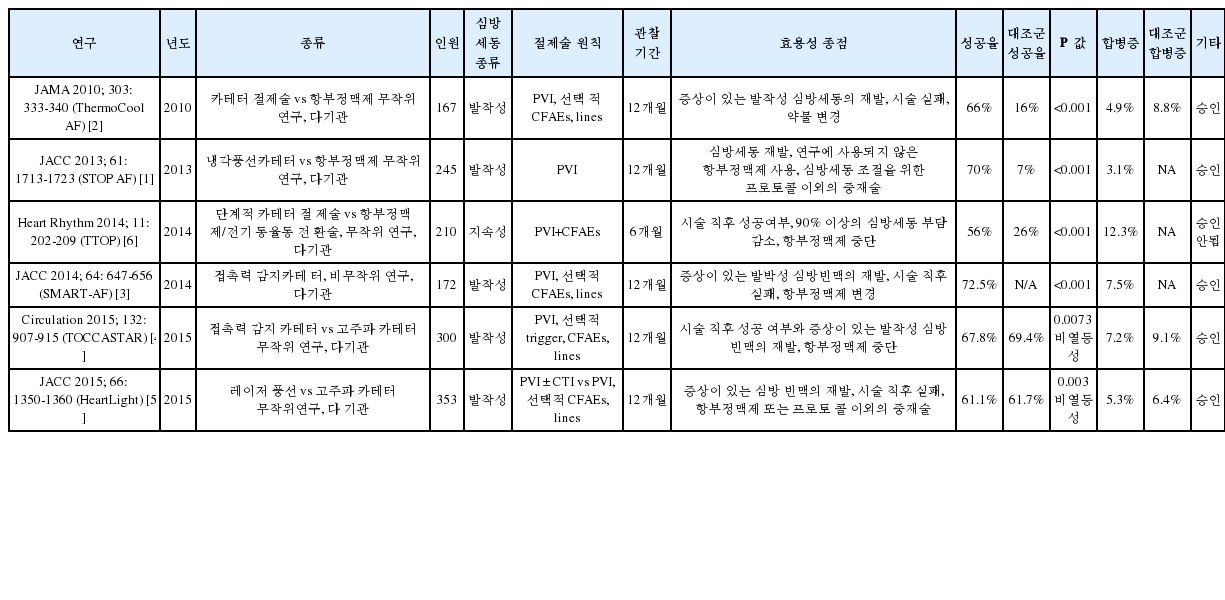
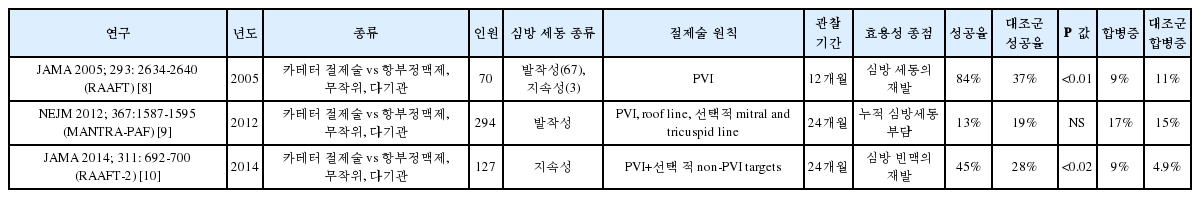
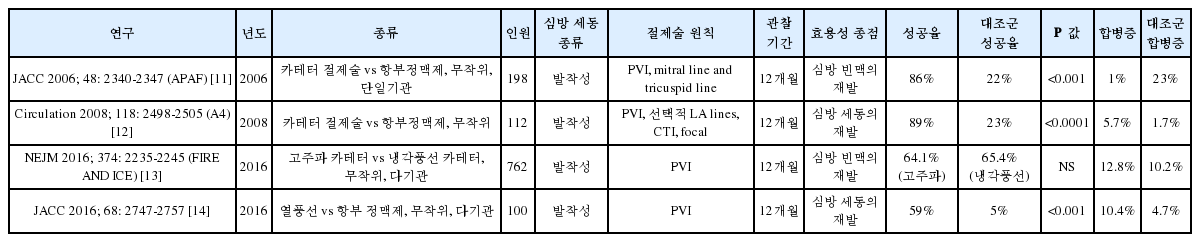
문헌 조사 : FDA 승인을 위한 임상 연구
초반 심방세동 카테터 절제술은 4mm 또는 8mm, 비관류 고주파 카테터를 사용하였다. 이후 관류 카테터를 이용한 연구와 냉각풍선 카테터를 이용한 연구가 진행되었다. 두 경우 모두 카테터 절제술이 (66% and 70%) 약물 치료 군에(16% and 7%) 비해 효과가 월등히 좋았다[1,2]. 이후에는 기존의 방법과 비교하여 새로운 기구들의 효용성을 비교하였다. 접촉력 감지 카테터와[3,4] 레이저 풍선 카테터[5] 에 대한 연구들이 그것이며, 12개월 성공율은 각각 61%, 72.5% 를 보였다.
심방세동 절제술의 1차 치료 결과
심방세동의 1차 치료로 카테터 절제술을 시행하는 것에 대한 연구 결과 비교적 젊고 구조 심질환이 없는 발작성 심방세동 환자에서 약물 치료 군에 비해 동율동을 오랫동안 유지하는 데 효과적이었다[7]. 하지만, 이러한 결과들을 고령의 환자군이나, 구조심질환이 있는, 혹은 지속성 심방세동에도 적용 하는 데에는 논란의 여지가 있다.
약제 저항성 심방세동의 카테터 절제술 결과(2차 치료 연구)
발작성 심방세동 연구에서는 대부분 폐정맥 고립술의 효과에 초점을 맞추었고, 12개월 성공율이 59%~89% 에 달한다. 모든 연구에서 약물 치료군에 비해 심방세동 조절 효과가 월등히 좋았다. 지속성 심방세동을 포함한 연구에서는 폐정맥 격리술 이외에 선형 절제술이나 CFAE 절제술 방법을 이용하였고, 6개월 혹은 12개월 심방세동 조절 성공률은 59%~80% 를 보인 반면, 약물치료 군에서는 9%~58% 의 효과를 보여, 모든 연구에서 절제술 군이 성적이 좋았다. 그러나 이 연구결과들로 절제술이 생존율에 미치는 영향을 평가하기엔 어려운 실정이다.
지속성 심방세동의 카테터 절제술 결과
지속성 심방세동은 심방의 전기적, 구조적 재형성으로 인해 생리학적 기전이 이질적이다. 이로 인해, 지속성 심방세동은 발작성 심방세동에 비해 카테터 절제술 재발률이 높다[15]. 지속성 심방세동을 대상으로 한 카테터 절제술의 가장 큰 대규모 연구는 STAR-AF 연구이다[16]. 지속성 심방세동 환자를 무작위 배정하여 폐정맥 격리술, 폐정맥 격리술과 선형 절제술, 또는 폐정맥 격리술과 CFAE 절제술 군으로 나누어 보았을 때 시술 성공율에 각 군은 차이를 보이지 않았다.
울혈성 심부전 환자의 심방세동 절제술 결과와 절제술이 좌심실 기능에 미치는 영향
심부전 환자에게 심방세동 절제술이 어떤 역할을 할 것인지에 대한 여러 연구들이 진행되어 왔다. 한 메타분석 연구에 따르면, 심방세동 절제술을 시행한 군에서 심박수 조절만 시행한 군과 비교할 때 좌심실 구혈율을 8.5% 증가시켰고, 삶의 질을 개선시켰다[22]. 최근 심부전 환자를 대상으로 한 대규모 연구가 발표되었고, 카테터 절제술군이 약물치료 군에 비해 사망률 개선과 심부전 악화로 인한 입원을 감소시키는 결과를 보였다.
비후성 심근증 환자의 심방세동 절제술 결과
심방세동은 비후성 심근증 환자의 흔한 합병증으로 알려져 있다. 특히, 이러한 환자군에서 심방세동 발생시, 증상 악화가 심하고 뇌졸중의 위험성이 올라가며 이와 관련한 사망률이 높아진다[28]. 따라서 비후성 심근증 환자에서 심방세동이 발생시 적극적인 리듬 치료가 필요하다. 하지만 이에 대한 대규모 연구는 현재 없는 상황이다. 메타 분석 연구 결과에서, 비후성 심근증 환자의 카테터 절제술 성공률은 38.7% 였고, 대조군은 49.5%로 보고되었다[29]. 재발율은 높지만 비후성 심근증 환자에서 카테터 절제술은 도움이 될 수 있고, 특히 발작성 심방세동이나 심방 크기가 작은 경우 더 효과적이다.
고령의 환자들에서 심방세동 절제술 결과
일반적으로, 여러 연구들에서 고령의 환자군과 젊은 연령의 환자군이 비슷한 절제술 성공률을 보였다. 그러나, 고령 환자군의 대상자수가 많지 않았고, 절제술을 시행한 고령의 환자들은 대부분 선택적인 환자군이 포함되었다. 확실한 사실은 고령의 환자들이 재시술을 받는 빈도는 매우 적었다.
젊은 연령의 환자들에서 심방세동 절제술 결과
심방 세동은 젊은 연령에 흔히 발생하는 부정맥은 아니다. 그러나 젊은 연령에서 발생시 증상이 심하고 지속적인 약물 치료를 원하지 않는 경우가 많아 카테터 절제술은 하나의 좋은 치료 방법이 될 수 있다. 젊은 연령의 심방세동 절제술 결과에 대한 연구는 제한적이나, 가장 대규모 연구로는 독일 연구로, 45세를 기준으로 결과를 비교하였다[30]. 이 연구에 따르면 젊은 연령층에서 합병증 발생율이 적고, 재원기간이 짧으며, 심방세동 재발율도 낮은 것으로 나타났다.
장기간 추적 관찰 결과
이전 연구들은 대부분 12개월 이내의 추적 관찰 결과들이었다. 장기간 추적관찰 한 결과, 지속성 심방세동과 다른 동반 질환을 갖은 경우 늦은 재발이 많이 발견되었다.
카테터 절제술이 삶의 질에 미치는 영향
증상 개선이 심방 세동 치료의 일차 목표이므로 카테터 절제술의 결과에 삶의 질 지표가 중요한 인자로 대두되고 있다. 하지만 심방 세동에 특화된 삶의 질 평가 지표는 없다. 최근 메타 분석에 따르면 카테터 절제술 군이 약물 치료군에 비해 초기 3개월의 삶의 질 개선을 보였으나, 차이가 점점 감소하여 9개월째에는 질지표 차이가 없는 것으로 보였다[31].
카테터 절제술이 좌심방 크기와 기능에 미치는 영향
심방세동은 심방의 전기적, 구조적, 기능적 재형성으로 인한 결과물이며 일종의 심근병증으로 볼 수 있다. 카테터 절제술을 통해 이러한 심방의 기능저하나 확장을 되돌릴 수 있기를 기대할 수 있다. 절제술 전후 심방 크기 변화에 대한 여러 연구들이 있다[32-35]. 대부분 절제술 후 심방 크기가 작아지는 결과를 보였고, 역재형성화는 동율동으로 유지되는 경우 더 두드러졌다. 하지만, 지속성 심방세동의 광범위한 절제술로 인해 형성된 흉터로 심방의 기능 저하를 초래하는 경우도 있다[36].
III. 합병증
개요
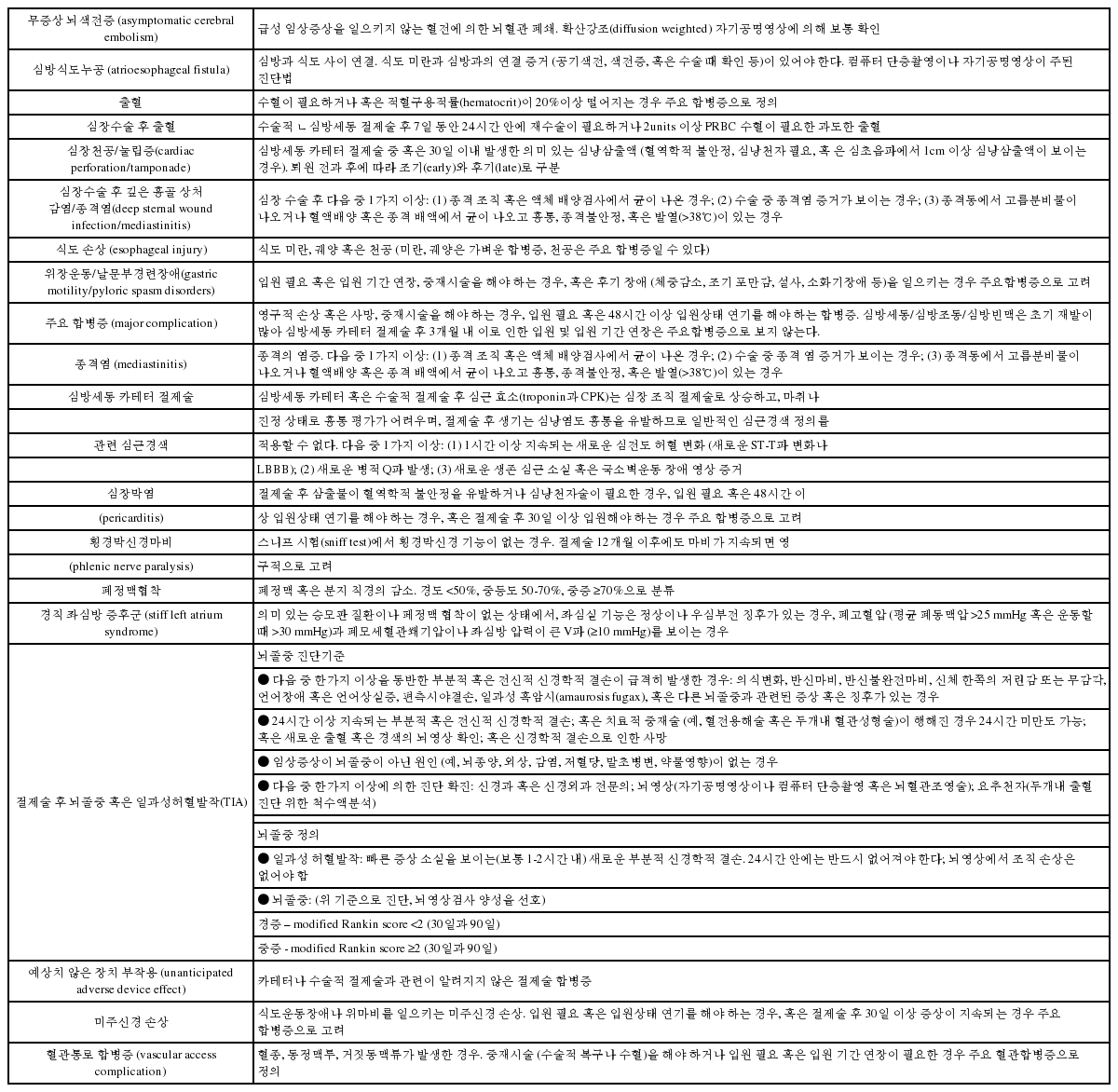
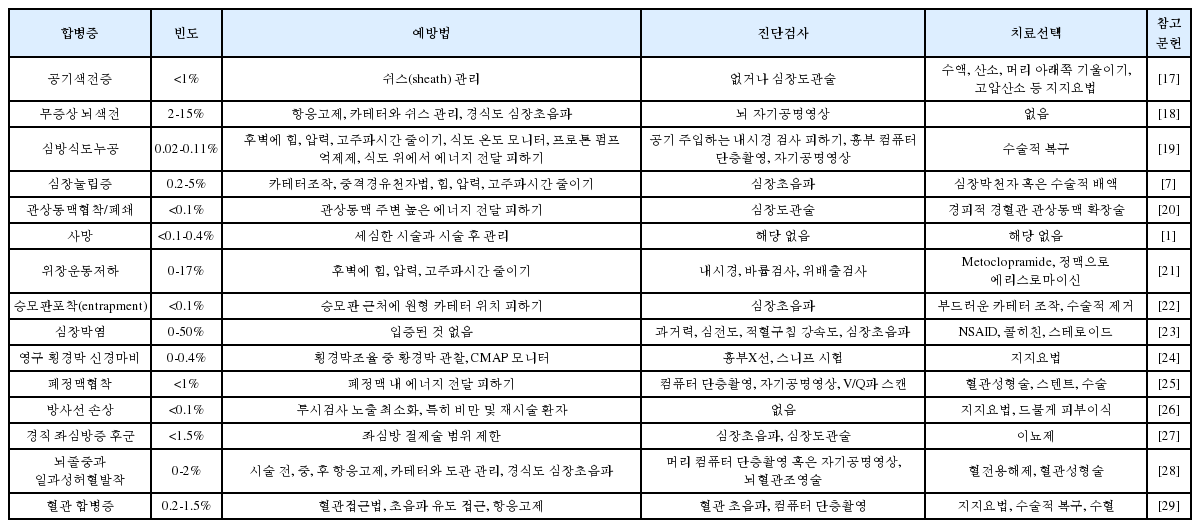
심방세동에 대한 카테터 절제술은 가장 복잡한 전기생리검사 시술 중 하나이다. 벽이 얇은 심방에서 카테터 조작과 절제술은 인접한 주요 장기 및 기관에 추가적인 손상을 일으킬 수 있으며, 이는 영구적인 장애와 사망을 포함한 심각한 합병증을 일으킬 수 있다. 2000년에서 2010년 사이 총 93,801건의 심방세동 카테터 절제술에 대한 Nationwide Inpatient Sample (NIS) 결과를 보면 총 합병증 발생률은 6.29%였고, 병원 내 사망률은 0.46%였다[1]. 여기서 시술자나 시술 건수가 적은 병원이 합병증 발생의 중요 예측인자였다. 또한, 심방세동 카테터 절제술 경험이 늘면서 경직 좌심방 증후군(stiff left atrium syndrome), 기침, 폐손상, 위장운동저하, 동빈맥 같은 새로운 합병증도 인지되고 있다. 여기서는 심방세동 카테터 절제술과 관련된 중요 합병증을 정의하고 (표 9), 합병증의 빈도, 예방, 진단과 치료에 대해 정리하겠다 (표 10).
심장눌림증(Cardiac tamponade)
심장눌림증은 심방세동 절제술과 관련된 가장 흔한 생명을 위협하는 합병증으로 총 사망률의 25%를 차지한다고 보고하였다. NIS 보고에 따르면 심장막 합병증 발생률은 1.5%였다. 일반적인 전기생리검사보다 심방세동 절제술 때 심장눌림증이 많이 발생하는 이유는 광범위한 심장 내 카테터 조작 및 절제술, 보통 2회 이상 필요한 중격 천자, 그리고 전신적 항응고치료 때문으로 생각된다[1,2]. 심장눌림증을 유발하는 심장 천공의 흔한 이유는 (1) 잘못 유도된 중격 천자(천자를 너무 뒤쪽으로 해서 우심방에서 좌심방으로 못 가고 심장막으로 가거나, 천자가 천정, 좌심방이, 좌심방 바깥벽을 통해 좌심방을 천자한 경우); (2) 직접적인 기계적 손상, 특히 좌심방이를 통한 경우; (3) 고주파 에너지 전달 중 과열(steam pop 동반 가능) 때문이다. 과도한 힘, 온도, 접촉력도 영향을 줄 수 있다. 시술 전후 항응고치료 및 시술 중 항응고치료 (시술 동안 안정적인 ACT(activated clotting time) 300초 이상 유지 위한 헤파린 주입)이 출혈 위험 및 출혈량을 악화시킬 수 있다. 한 대규모 연구에서 비타민K 길항제를 중단하지 않는 치료가 중단하고 헤파린으로 교차 한 경우보다 심장눌림증 발생이 더 증가하지 않는다고 보고하였다[3]. 다른 연구는 INR (International Normalized Ratio) 2 미만과 2를 초과한 환자의 심장눌림증을 비교하여 초기 심장막 배액, 배액 기간, 수술이 필요했던 경우에서 차이가 없음을 보고하였다[4]. 심방세동 절제술 중 시술 전후 항응고치료 최근 경향은 NOAC(novel oral anticoagulant) 치료 중단 없이 시술하는 것을 포함하고 있다. RE-CIRCUIT 연구는 심방세동 절제술 중 중단하지 않는 dabigatran군과 와파린군을 직접 무작위 비교하였는데, 총 635명 중 시술 후 8주동안 주요 출혈 발생 빈도는 dabigatran군이 와파린군보다 의미 있게 낮았다 (5명 [1.6%] vs 22명 [6.9%]; absolute RD -5.3%; RR reduction 77%) [5]. 최근 메타분석연구는 NOACs을 쓰면서 심방세동 절제술을 하는 것이 경도 출혈 위험도가 더 낮고 뇌졸중, 일과성허혈발작, 심장눌림증, 혹은 서혜부혈종 발생은 큰 차이가 없음을 보고하였다[6]. 다른 메타분석연구는 여성이 남성보다 1.83배 심장눌림증 발생 위험이 높고, 시술센터의 크기와 발생률은 역의 관계를 보인다고 보고하였다[7]. 1,308건의 냉각풍선 절제술에 대한 메타분석은 심장삼출/눌림증 발생률이 1.5 % 로 보고하였다[8]. 냉각풍선 절제술과 전극도자 절제술을 전향적으로 비교한 최근의 무작위 연구는 심장눌림증 발생률이 1.3% 대 0.3%로 냉각풍선 절제술 우위를 보여 주었지만, 최근 도입된 접촉력 감지 카테터의 영향은 고려하지 않았다[9]. Smart Touch 카테터를 이용한 SMART-AF 연구는 161명의 환자에서 2.5%의 심장눌림증을 보고하였다[10]. TOCCASTAR 연구는 접촉력 감지 카테터 (Endosense)군과 일반적인 전극도자 카테터군을 무작위 배정하였는데 심장눌림증 발생률은 양 군에서 차이가 없었다 (0.66% vs 0.7%, P = NS) [11].
심장눌림증은 시술 후 1시간에서 수 주에 걸쳐서도 나타날 수 있으며, 지연된 심장눌림증 발생률은 0.2%로 보고되었다[12]. 심장눌림증은 갑작스런 혈압저하뿐 아니라 점진적인 혈압저하로도 나타난다. 이때 수액공급으로 일시적인 혈압 정상화를 보일 수도 있으나, 진단이 지연되면 치명적일 수 있으므로 항상 경계해야 한다. 심장눌림증의 초기 징후는 수축기 혈압이 떨어지면서 동시에 투시검사에서 심장 윤곽운동이 감소하는 것이다. 그러나, 소량의 증상 없는 심장막 삼출액은 심방세동 절제술 후 흔히 볼 수 있으므로 감별이 필요하다. 심장 내 초음파를 이용하면 심장막 삼출의 초기 진단에 도움이 된다고 보고되었다. 대부분 심장눌림증은 즉각적인 경피적 배액과 프로타민으로 항응고제를 중화시키면 조절될 수 있다. 와파린을 쓴 경우 신선냉동 혈장이 종종 사용된다. Xa 인자 억제제를 쓴 환자는 4-factor prothrombin complex concentrate가 종종 사용된다. Dabigatran의 경우 idarucizumab을 쓰면 신속히 항응고효과를 되돌릴 수 있다[13]. Xa 인자 억제제에 대해 andexanet alfa도 중화시킬 수 있으나 임상승인은 되지 않은 상태이다[14]. 경피적 배액은 검상하 Seldinger법으로 심낭을 천자하고 심낭 내에 도관을 위치하는 것이 최상이다. 심낭천자는 해부학적 기준점을 바탕으로 투시검사나 심초음파 유도에서 할 수 있다[15]. 초기 흡인 후, 혈압은 즉시 회복되며, 배액 후 배액관을 통해 계속되는 출혈을 모니터 해야 한다. 배액관은 보통 절제술 후 최소 12시간까지 유지한다. 드물게 찢어지거나 관을 통환 배액이 불충분하면 수술적 배액이나 복구가 필요할 수 있고 한 메타분석에서는 심장눌림증의 16%가 수술이 필요했다고 보고하였다[16]. 심장눌림증은 조기 인지와 재빠른 처치가 뇌 및 중요기관의 비가역적인 손상 예방에 필수이다.
폐정맥협착
폐정맥협착은 심방세동 절제술의 잘 알려진 합병증으로 내막, 중간막, 외막, 폐정맥 근육층을 포함한 폐정맥의 열손상으로 생긴다. 정확한 병태생리 기전은 불확실하지만, 개의 폐정맥에 시행한광범위 고주파 절제술 결과에서 점진적인 신생혈관내막 증식과 심근섬유화가 혈관 내 수축을 일으킴을 보고하였다[30]. 폐정맥협착은 점 단위 고주파 절제술뿐 아니라 냉각풍선 절제술에서도 보고되었으나, 레이저 풍선의 경우는 아직 보고되지 않았다[31]. 폐정맥협착의 가장 높은 위험도는 폐정맥 입구 혹은 안에서 고주파 절제술을 하는 것과 관련이 있고, 심방의 동(antrum)에서 하는 것보다 위험성이 5.6배 더 높아, 폐정맥 내 절제술은 반드시 피해야 한다[32]. 그 외, 3차원 전기해부지도의 변동, 호흡 움직임, 카테터 불안정, 미숙련된 시술자 등의 요인으로도 생길 수 있다. 폐정맥협착 빈도는 0-40%로 보고에 따라 다양한데, 이는 절제술 차이, 폐정맥협착의 정의, 합병증 감시 정도, 연구날짜 등의 영향 때문이다[33]. 폐정맥협착 관련 증상은 절제술 후 보통 수 주에서 수 개월 지나 발생하는데, 주된 증상은 호흡곤란, 객혈, 기침, 반복되는 폐감염 혹은 폐렴, 흉통이다. 이런 증상들은 종종 폐렴, 폐색전증, 심지어 폐암으로 오진되기도 한다. 시술 1개월 뒤 영상에서는 정상이다가 3개월 뒤 협착이 진행한 사례도 있으며, 심한 협착이라도 증상이 없는 경우도 있다[34]. 직경이 좁아진 정도에 따라, 경도 (<50%), 중등도 (50-70%), 중증 (>70%)로 보통 정의한다. 폐정맥협착은 어느 폐정맥이든 생길 수 있으며, 일부에서는 다발성 폐정맥협착도 보고되었다[34]. 진단방법은 컴퓨터 단층촬영, 자기공명영상, 관류스캔, 경식도 심장초음파, 폐정맥조영술 등이 있으며, 이 중 컴퓨터 단층촬영이나 자기공명영상이 폐정맥협착 위치와 정도를 정확하게 볼 수 있으므로 더 선호된다. 자기공명영상은 폐관류 자료를 동시에 얻을 수 있고 방사선 노출이 없다는 추가적인 이점이 있다. 최근 폐정맥협착 빈도는 줄고 있으나, 여전히 중요한 합병증인 이유는 치료가 어렵고 드물게 사망까지 유발할 수 있기 때문이다. 중재시술 적응증은 증상이 있는 경우이다. 무증상 혹은 경한 증상의 폐정맥협착은 지지요법이며, 경과관찰 중 측부혈관 생성 및 보충으로 증상 호전을 볼 수 있다[35]. 증상이 있는 경우는 폐정맥성형술을 고려해야 하는데, 두 군데 이상 혈관이 막힌 경우는 문제 병변을 찾기 위한 관류영상을 고려할 수 있다. 목표 폐정맥이 완전히 막힌 경우, 확장술은 종종 복잡해지며, 재구성된 좌심방을 결합한 3차원 전기해부지도를 사용하는 것이 폐쇄된 폐정맥의 정확한 위치를 찾는데 도움이 되며 이전 컴퓨터 단층촬영이나 자기공명영상도 폐정맥 구조를 파악하는데 도움이 된다[36]. 많은 폐정맥협착은 경직되어 있어 넓히기 힘들다. 또한 혈관성형술이 성공했더라도, 폐정맥 재협착이 50% 이상에서 생긴다[33]. 8-10 mm 이상 직경의 스텐트를 넣었을 때 재협착 위험도가 의미 있게 낮다는 보고가 있다. 중재시술 합병증으로 좌심방 천공 (심장눌림증 동반 가능), 폐정맥박리(과도 출혈 동반 가능), 스텐트 이탈 및 색전증이 생길 수 있다[37]. 항응고제 및 항혈소판제 사용에 대해서는 제한된 자료만 있다. 심방세동에 대해 항응고제를 쓰고 있던 경우는 clopidogrel을 추가하는 방법이 가장 많이 사용되고, 항응고제 적응증이 없는 경우는 와파린과 clopidogrel을 함께 쓴다. 항응고제를 언제까지 써야 하는 지는 불명확한데, 폐정맥 재협착 경우는 평생 사용이 필요하겠다. 1-2년 후 폐정맥 스텐트가 안정된 경우 clopidogrel을 먼저, 그리고 순차적으로 와파린을 중단해 볼 수 있다. NOACs의 경우는 아직 연구되지 않았다. 중재시술에도 불구하고 재협착이 와서 지속되는 경우라도 반복되는 재감염이나 객혈은 드물고 보통은 치료가 되며, 폐나 엽절제를 필요로 하는 경우는 거의 없다. 성공적인 폐정맥 혈관성형술이나 스텐트를 삽입한 경우 증상은 의미 있게 개선된다[37]. 추적검사 시기나 빈도는 증상에 따라 결정되어야 한다. 재협착이 발생한 환자는 보통 시술 전 있었던 불편을 이야기 하는데, 이 때 추천검사는 자기공명영상이다. 3개월째 추적 컴퓨터 단층촬영이나 자기공명영상을 하지 않았다면 최소한, 절제술 후 폐관련 증상이 재발한 경우 폐정맥협착을 배제하기 위한 검사를 해야 한다. 추적 관찰하는 동안 환자의 증상을 모니터 하여야 하며, 심각한 문제가 발생하기 전 폐정맥협착을 확인하는 것이 중요하겠다.
식도혈종, 심방식도누공, 심방심장막누공
식도손상은 카테터 혹은 수술적 심방세동 절제술의 가장 중요한 합병증 중의 하나이다.
1) 식도혈종
식도는 경식도 심장초음파의 탐색자에 의한 직접적인 손상을 받을 수 있다. 최근 연구에서는 심방세동 절제술 전 경식도 심장초음파를 하다가 식도혈종의 발생 가능성을 0.27%로 보고하였다[38]. 주된 증상은 검사 12시간 내에 나타나는 삼킬 때 통증, 역류, 쉰소리였다. 발열이나 신경학적 증상은 없었다. 진단은 컴퓨터 단층촬영으로 심방식도누공을 배제하고 혈종이 위쪽 식도에 국한되어 있거나 식도를 따라 퍼진 것을 보고 확인할 수 있으며, 내시경검사로 확진 가능하고 지지요법이 권고된다. 식도혈종의 장기간 후유증으로 식도협착, 식도운동장애, 성대마비가 올 수 있다[38].
2) 심방식도누공과 심방심장막누공
식도궤양, 천공, 좌심방식도누공, 심방심장막누공은 심방세동에 대한 카테터 및 단극 고주파전류를 이용한 수술 절제술 모두에서 보고되었으며 심방 전층 손상을 일으킬 수 있는 어떤 에너지를 사용하든 발생할 수 있다[39]. 식도궤양 발생이 심방식도누공 발생을 예측할 수는 없으며, 심방식도누공이 궤양에 의해 발생할 수 있지만, 빈도는 궤양이 발생한 환자 1,000명 중 1명 정도이다. 정확한 식도손상 기전은 모르지만, 잠재적 가능성은 직접적인 열손상, 산의 역류, 장관에서 감염, 말초 세동맥의 열성 폐쇄로 인한 허혈성 손상 등이다. 좌심방 후벽 절제술 때 미주신경 손상이 식도 아래쪽 조임근 압력을 떨어뜨려 위식도역류를 유발한다는 가설도 있다[40]. 심방식도누공과는 달리 심방세동 절제술 후 증상이 없는 식도 손상은 매우 흔하데, 절제술 1-3일 뒤 시행한 내시경에서 발견된 식도조직 손상은 50%까지 보고되었다[41]. 증상 없는 식도 궤양은 경과 관찰만 해도 보통 2-3주 뒤 대부분 호전되었고, 프로톤 펌프 억제제 (pantoprazole 혹은 esomeprazole)나 sucralfate로 치료한 후에는 다 회복되었다. 다요인 분석에서는 좌심방과 식도 사이 거리가 유일한 독립적 예측 인자였고, 승모판막 협부 line이나 관상정맥동(coronary sinus) 절제술은 경향만을 보였다[42]. 한 연구에서는 전신마취를 했을 때가 얕은진정을 했을 때보다 식도손상 빈도가 높다고 보고하였는데, 반사 반응 소실과 식도운동저하가 관련되었을 것으로 생각된다[19]. 심방식도누공의 임상증상은 보통 절제술 후 2-4주 때 나타난다. 가장 흔한 증상은 발열과 반복되는 신경학적 이상 (패혈색전증)인데, 패혈쇼크, 식도출혈, 사망일 수도 있다. 선호되는 진단검사는 흉부 컴퓨터 단층촬영이지만, 정상 컴퓨터 단층촬영 결과가 심방식도누공을 100% 배제할 수는 없다. 임상적으로 의심되는 경우 지속적인 주의와 검사가 중요하다[43]. 누공 진단을 위해 바륨을 삼켜볼 수 있지만 민감도는 낮으며, 공기를 주입하는 내시경검사는 공기가 큰 공기 색전을 만들어 뇌졸중 혹은 사망을 일으킬 수 있으므로 절대 해서는 안 된다. 합병증을 줄이기 위해서는 심방 후벽 (최소한 식도 주행경로 위)에서 절제술 피하기와 고주파 에너지 줄이기 (25W 이하), 심장 내 초음파 이용, 식도 열 감지센서 사용 등이다[42]. 식도 열 감지센서를 사용해도 식도 손상 위험을 없앨 수는 없지만, 사용할 때는 절제술 때 최대한 카테터 근처에 위치시켜야 한다. 미리 정한 온도 (예, 39 혹은 40℃)에 도달하던가 보존적으로는 0.2℃ 상승으로도 절제술을 중단하는 센터도 있다. 냉각풍선을 쓸 때는 -20℃ 밑에서 보통 중단한다. 대안으로 내시경이나 소침(stylet)을 써서 절제술 부위에서 식도를 미리 이동시키는 방법도 있다[44]. 프로톤 펌프 억제제를 보통 절제술 후 1-4주 정도 쓰는 경우가 많은데, 절제술 후 내시경에서 식도궤양이 많이 보이는 것에서 근거를 둔 방법으로 그 효과가 입증된 것은 아니다. 심방식도누공 치료는 응급상황이므로 긴급한 수술적 복구가 필요하다[43]. 최근 연구는 수술적 복구의 사망률은 34%, 하지 않은 경우는 83-100%로 보고하였다. 일부 연구에서 식도천공, 심방심장막누공의 경우 식도 스텐트 삽입의 긍정적 결과를 보고하였으나, 심방식도누공의 경우는 100% 사망하였다[45]. 심방식도누공은 드물지만 예측할 수 없고 치명적인 결과를 낳으므로, 조심스럽게 좌심방 후벽에서 에너지를 사용하고 조기 감지 및 조기 중재시술을 해야 하겠다.
위장운동저하와 식도주위 미주신경 손상
좌심방 후벽에 고주파 에너지가 전달될 때 식도신경얼기 앞쪽의 미주신경이 손상되면 급성 날문부 경련과 위장운동저하를 일으킬 수 있다. 이럴 경우 구역, 구토, 복부팽만, 복통이 시술 후 수 시간에서 수 주 내 나타날 수 있고 일부에서 동성빈맥을 호소할 수도 있다[46]. 위장 증상은 17%까지 보고되며, 한 연구는 상부 위장관의 무증상 기능장애가 74%의 환자에서 발생하였다고 보고하였다. 회복시간은 2주 이내부터 더 긴 시간까지 다양하다[21]. 초기 평가로 내시경 혹은 하루 금식 후 잔류 음식을 확인하는 바륨 삼키기 검사를 할 수 있다. 컴퓨터 단층촬영으로 위장 확장을 확인할 수 있거나, Technetium-99로 표시한 고형식으로 지연 위배출을 볼 수도 있다. 13C-acetate 호흡검사는 섬광조영술(scintigraphy)의 비침습적인 대체검사로 할 수 있고 실시간 자기공명영상이 위장운동과 날문부 경련을 평가하는데 사용할 수 있다[46]. 치료는 증상의 정도와 함께 위장 운동 장애와 날문부 경련 중 무엇이 주된 문제 인지에 따라 결정된다. 소량의 저지방, 저섬유질 식사가 증상을 완화시킬 수 있다. 에리스로마이신 정맥주사가 당뇨성 위마비의 초기에 도움될 수 있으나 심방세동 절제술 후의 케이스에 대해서는 평가되지 않았다. Metoclopramide가 위장 운동 개선을 위해 1-3개월 동안 쓸 수 있으나 장기간 사용할 경우 운동장애의 위험성이 있다. 보툴리눔 주사나 수술이 날문부 경련을 완화시키는데 필요할 수도 있으며, 심한 경우 수술이나 위장 조율(pacing)이 필요할 수 있다[47]. 미주신경 손상을 예방하기 위한 확립된 방법은 없지만 심박식도누공을 피하기 위한 방법으로 위험도를 줄일 수 있겠다. 최근 연구는 체질량지수가 높고 좌심방 후벽에서 에너지를 20-25W로 제한하는 것이 심방세동 절제술 때 식도주위 신경손상을 예방할 수 있다고 제시하였다[48].
횡경막 신경 마비
횡경막 신경 마비는 심방세동 절제술의 중요 합병증으로, 상대정맥과 우측 페정맥 (특히, 우측 위 폐정맥)에서 절제술을 할 때 근처를 지나는 오른쪽 횡경막 신경이 주로 손상을 받는다[49]. 횡경막 신경 마비는 증상이 없을 수도 있고 호흡곤란, 빈호흡, 기침, 딸꾹질, 흉통을 일으킬 수도 있다. 진단은 시술 후 흉부 x-선에서 반쪽가로막이 새롭게 올라가면서 같은 쪽 폐 하부에 무기폐가 동반된 것이 보이면 의심할 수 있고, 투시검사나 초음파로 횡경막 운동을 평가하여 확진할 수 있다(sniff test). 횡경막 신경 손상이 일어나는 가장 흔한 경우는 냉각풍선 절제술을 할 때로, 일시적 횡경막 신경 마비가 3.5-11.2%에서 보고되었다. 이 경우에도 영구적 횡경막 신경 마비는 매우 드문데 FIRE AND ICE 연구에서는 0.3%로 보고하였다[9]. 횡경막 신경 마비는 레이저풍선 절제술에서도 보고되었는데 HeartLight 연구에서는 횡경막 신경 손상으로 이차적인 횡경막 마비가 3.6%에서 발생, 이는 카테터 절제술보다 높았다. 1년 째 영구적인 손상은 1.8%에서 발생하였다[50]. 열풍선(hot balloon) 절제 카테터의 경우도 최근 연구에서 횡경막신경 손상 빈도가 3.7%로 보고하였다[51]. 풍선을 이용한 심방세동 절제술에서 횡경막 신경 손상이 많이 생기는 여러 기전이 제시되었는데, 첫째, 우측 위 폐정맥 폐쇄를 위해 가해지는 풍선의 압력이 폐정맥과 횡경막 신경 사이의 거리를 줄인다. 둘째, 폐정맥 직경보다 작은 크기의 풍선이 정맥의 원위부를 절제할 가능성이 높다. 셋째, 넒은 둘레 온도 차이와 추가적인 냉각 주기가 용량 의존성 신경 마비 위험도를 증가시킬 수 있다는 것이다. 연구들은 23mm 풍선이 28mm 풍선보다 횡경막 신경 손상 위험도가 더 높은 것을 보여주었다[52]. 또한 횡경막 신경 마비는 고주파 에너지를 써서 광범위 주위 절제를 할 때도 발생할 수 있는데, 우측 폐정맥 앞쪽으로 가는 횡경막 신경에 열손상을 줄 수 있기 때문이다. 두 번째로 흔한 횡경막 신경 마비의 경우는 점단위로 고주파 절제술을 시행하여 상대정맥(superior vena cava)의 전기적 분리를 시킬 때로 발생률은 2.1-10% 보고하였다[53]. 잔류(persistent) 왼쪽 상대정맥 내에서 절제술은 냉각풍선을 쓸 때 드물게 왼쪽 횡경막 신경 마비를 일으킬 수 있고, 매우 드물게는 좌심방이의 천정에서 절제술 때도 발생할 수 있다. 오른쪽 폐정맥 광범위 주위절제 및 융기(carina) 절제를 할 때 환자의 30%에서 횡경막 신경이 범위 안에 포함되지만, 횡경막 신경 마비는 0.17-0.48%로 보고된다[49]. 이런 결과들은 냉각풍선 절제술의 높은 손상 위험성에 해부학적 근접성 외 다른 인자들이 중요함을 보여준다. 횡경막 신경 마비를 예방하기 위한 많은 전략들이 시도되어 왔다. 다양한 풍선 조작으로 폐정맥 동(antrum) 근처 절제술을 최소화하기, 고출력 조율로 절제술 전 횡경막 신경이 포착되는지 확인, 전기해부학적 지도화(electroanatomic mapping)를 이용하여 횡경막 신경 주행 표시, 복부 촉진과 횡경막 운동 감시, 투시검사, 절제술 중 상대정맥 혹은 쇄골하정맥에서 횡경막 신경 조율을 하는 동안 심장 내 초음파로 감시하는 것 등이다[54]. 우측 횡경막 신경 조율을 감시하는 것은 냉각풍선 절제술의 표준 방법이며 고주파에너지를 이용한 상대정맥 절제술 동안에도 고려해야 한다. 절제술 중 횡경막의 compound motor actin potentials을 모니터하는 횡경막 근전도검사는 횡경막 신경 마비를 조기에 감지할 수 있는 방법으로 마비의 발생빈도를 줄일 수 있는 것으로 보고되었다[55]. 냉각풍선 절제술 때 대부분의 횡경막 신경 손상은 일시적이며 수 분 내 회복된다. 지속되는 신경마비도 대부분의 신경 기능은 수 주 내 회복되고, 12개월 내 거의 다 회복된다. 일부에서 18-24개월까지 걸렸다는 보고도 있다. 냉각풍선 절제술을 받은 1,308명을 대상으로 한 대규모 메타분석에서 4.7%가 절제술 후 지속되는 횡경막 신경 마비가 있었으나, 0.37%만 1년 이상 지속되었다고 보고하였다[52]. 횡경막 손상의 회복을 촉진하는 치료는 없으나, 영구 신경손상으로 증상이 있는 환자에서 횡경막 주름형성(plication)이 호흡곤란과 기능을 개선할 수 있다.
뇌졸중, 일과성허혈발작, 증상 없는 미세색전증(microemboli)
1) 뇌졸중과 일과성 허혈발작
공기나 혈전에 의한 색전증은 심방세동 절제술의 가장 중요한 합병증의 하나로 뇌, 관상동맥 및 말초혈관 이상을 일으킬 수 있다. 심방세동 절제술과 연관된 혈전색전증 빈도는 0-7%로 보고된다[56]. 혈전색전증은 보통 절제술 후 24시간 내 발생하고, 2주까지가 고위험 기간이다. 좌심방 내 쉬스 혹은 카테터 주위 혹은 안에서 혈전 생성, 절제술 카테터 끝이나 절제 시행한 곳에서 char 발생, 절제술 전 심방에 있던 혈전 파열, 시술 중 전기 심장율동 전환 등이 혈전색전증 발생에 대한 이유로 제시되고 있다[57]. 이런 합병증 발생은 시술 전 상세한 영상평가, 엄격한 항응고치료 요법, 섬세한 쉬스 관리, char 형성을 최소화하기 위한 고주파에너지 관리 등으로 줄일 수 있다. 증상이 있는 혈전색전증의 진단은 보통 간단한데, 동맥 폐쇄로 생긴 허혈 혹은 경색이 해당 조직의 관류를 떨어뜨리기 때문이다. 잠재적인 증상은 두개 내, 관상동맥, 복부, 말초동맥 등 어디가 막혔는가에 따른다. 혈전색전증 치료도 혈전이 막힌 부위에 따라 달라진다. 말초동맥 색전증은 수술적 혈전제거술로 치료되는 반면, 뇌 혈전색전증은 전통적으로 보전적인 방법으로 치료하였다. 그러나, 침습적인 혈전용해제나 경피적 중재시술을 하는 조기 치료에 대한 관심이 증가하고 있다.
2) 증상 없는 뇌 색전증
증상 없는 뇌 색전증은 색전에 의해 뇌혈관이 막혔으나 어떤 급성 증상도 없는 상태로 정의한다[58]. 심방세동 절제술 동안 혈전을 포함한 미세색전의 잠재적 원인은 심장내 카테터, 도관, 카테터 삽입 혹은 제거 때 쉬스로 들어간 공기, 심장 내 떨어진 혈전, 절제술 중 생긴 혈전이나 가스 등이다. 확산강조(diffusion-weighted, DW) 자기공명영상 (and/or fluid attenuated inversion recovery, FLAIR 영상)은 급성 허혈 손상을 확인하는데 민감도가 매우 높고, 시술 후 30분 안에 색전으로 인한 뇌병변을 감지할 수 있다. 여러 연구들은 확산강조 자기공명영상으로 심방세동 절제술 후 50% 정도에서 색전에 의한 새로운 급성 병변을 찾을 수 있다고 보고하였다[59]. 한 연구에서는 심방세동 절제술 후 50군데의 새로운 증상 없는 뇌색전이 있는 14명 환자를 평균 3개월 뒤 확산강조 자기공명영상과 T2 FLAIR영상을 다시 시행한 결과, 47군데 (94%)가 회복되었음을 보고하였다. 아직 무증상 뇌 색전증과 신경인지기능 감소와의 직접적인 관계는 밝혀지지 않았다[60]. 무증상 뇌 색전증을 줄이기 위한 방법으로는 (1) 시술 전, 중, 후 적극적인 항응고요법; (2) 주의 깊은 쉬스 관리; (3) 단계적인 고주파에너지 전달 수정; (4) 절제술 에너지원과 병변 선택 등이 있다. 심방세동 절제술 후 무증상 뇌 색전증의 장기간 예후 영향에 대해서는 불명확하다.
공기색전증
공기색전증의 가장 흔한 이유는 중격경유 쉬스를 통한 공기 유입이다. 주입관을 통해서도 일어날 수 있지만, 쉬스를 뺄 때도 흡입과 함께 발생할 수 있다. 공기색전증은 관상동맥조영술, 좌심방으로 접근하는 경피적 중재시술, 그리고 절제술에서 보고 되었다. 뇌 혈관에 생긴 공기색전증은 의식변화, 경련, 부분적인 신경학적 징후를 나타낼 수 있다. 중추신경계 장애는 소동맥의 기계적 폐쇄와 공기로 손상 받은 편평상피의 혈전-염증반응으로 발생한다[61]. 임상적인 의심에 따른 즉각적인 진단과 치료가 기본이지만, 혈관 내 공기가 흡수되기 전 자기공명영상이나 컴퓨터 단층촬영을 하면 뇌 혈관 내 공기가 만든 다발 사행 저음영과 뇌 경색을 볼 수도 있다. 더 중요한 것은 절제술 후 공기색전증이 보인다면 심방식도누공을 꼭 감별해야 한다. 심방세동 절제술 중 공기색전증의 흔한 증상은 급성 하벽경색과 방실차단인데, 이것은 바로 누운 자세에서 우관상동맥 입구가 위쪽에 위치하여 공기 색전이 우관상동맥 쪽으로 잘 이동하기 때문이다. 지지요법으로 보통 수 분 내에 증상과 징후가 완전 회복될 수 있다. 그러나 저혈압과 방실차단이 지속된다면 조율과 심폐소생술이 필요할 수 있다. 최근 한 연구에서 2,976명의 심방세동 절제술 시술 중 5건의 대량 공기색전증 결과를 보고하였는데, 혈역학적 허탈과 저산소혈증이 모든 환자에서 10-35분 동안 지속되었지만, 모두 완전 회복되었음을 보고하였다[62]. 그러나 모든 쉬스에 공기방울이 있는지 잘 감시하는 것이 중요하며 쉬스를 뺄 때도 천천히 빼서 흡인효과를 최소화 하고 도관 내 물기둥과 함께 빠지도록 해야 한다. 큰 쉬스를 통한 풍선카테터를 넣거나 뺄 때는 더 각별한 주의가 필요하다[63]. 뇌 공기색전증이 의심되면 치료는 신속히 시술실 내에서 이루어져야 한다. 초기 단계에 가장 중요한 것은 수액주입과 산소공급으로 뇌순환을 최대화하는 것이다. 이렇게 함으로써 공기방울 내 질소의 흡수율을 증가시킬 수 있다. 큰 공기색전의 경우, 일시적으로 환자의 머리를 낮추는 자세를 취하는 것이 도움이 될 수 있다. 고압산소 치료도 수 시간 내 할 수 있다면, 상태를 호전시키고 내막의 혈전-염증반응을 최소화할 수 있다[61].
혈관 합병증
혈관 합병증엔 서혜부 혈종, 후복막 출혈, 대퇴동맥 거짓동맥류, 동정맥루 등이 있으며 심방세동 절제술의 가장 흔한 합병증이다. 이 중 가장 심한 합병증인 대퇴동맥 거짓동맥류, 동정맥루, 후복막 출혈의 빈도는 0.2-1.5%로 보고되었다. 미국에서 2000에서 2010년 사이 심방세동 절제술을 받은 93,801명 환자 중 수혈이나 수술적 복구를 받은 빈도는 1.53%로 2,000년에서 2,010년 사이 빈도는 통계적인 차이가 없었다[1]. 대부분 서혜부 혈종은 지지요법이나 초음파 유도 압박에 의해 치료될 수 있으나, 대퇴동맥 거짓동맥류, 동정맥루, 후복막 출혈의 경우는 수혈이나 수술적 혹은 경피적 복구가 필요하고, 이는 유병률과 재원일수 증가로 이어진다. 드물게, 크고 치밀한 혈종의 경우 대퇴부 신경 후유증을 일으킬 수 있다. 이런 합병증의 빈도는 사용하는 정맥쉬스 수와 크기, 동맥압 측정 라인 삽입, 시술 전, 중, 후 사용하는 항응고치료와 관련될 수 있다. 최근 연구들은 와파린을 중지하지 않고 사용하는 것을 최적의 항응고요법으로 권고했는데, 이 방법이 와파린을 중단하고 헤파린을 이어 쓰는 방법보다 뇌졸중과 중요하지 않은 출혈 합병증을 줄였기 때문이다[64]. 또한, NOAC을 중단하지 않거나 일시적으로 중단한 방법이 와파린을 중단하지 않는 방법과 비교할 때 효과나 안정성에서 거의 유사함도 보고하였다[65]. 대퇴정맥에 접근하는 방법이 혈관 합병증의 위험도에 영향을 줄 수 있다. 대퇴정맥의 아래쪽에서 접근할 경우, 대퇴동맥의 작은 안쪽 가지를 관통해 대퇴 거짓동맥류이나 동정맥루를 만들 수 있고, 위쪽으로 접근할 경우는 후복막 출혈 위험도를 높인다. 이런 혈관 합병증을 예방하기 위해서는 실시간 초음파 유도 정맥천자를 할 것을 권고한다. 이 방법은 심방세동 절제술뿐 아니라 전기생리검사에서도 주요 및 경도 혈관합병증을 줄일 수 있기 때문이다[66].
급성 관상동맥 폐쇄와 협착
심방세동 절제술 중 관상동맥 손상은 드물다. 한 연구에서는 심방세동 절제술을 받은 5,709명의 환자 중 관상동맥 손상은 8명 (0.14%)에서 관찰되었다. 좌회선관상동맥이 좌심방의 외측과 가까워 절제술을 인접한 관상정맥동 안, 바깥쪽 승모판막 협부(mitral isthmus), 좌심방이 바닥쪽 근처에서 할 때 손상 받을 가능성이 있다[67]. 다른 연구는 승모판막 협부에서 절제술을 하는 동안 ST분절 변화를 동반한 급성심근경색이 생겼음을 보고하였다[68]. 1/3정도에서 좌회선관상동맥 근위부에서 나오는 동결절동맥은 좌심방 앞쪽과 상대정맥 중격 쪽으로 주행하므로 절제술 중 손상 받을 가능성이 있다. 이 경우 일시적인 동결절장애가 보일 수 있고 일부에서는 영구 심박동기 삽입이 필요한 경우도 있다[69]. 대정맥-삼첨판 협부도 심방세동 절제술 때 함께 절제할 수 있는데, 가까이 있는 우관상동맥이 손상을 받을 수 있다. 급성기 혹은 나중에 발생할 수도 있으며, 절제술이 중격쪽이나 바깥쪽으로 갈 때와 연관된다. 절제술하는 곳에서의 직접적인 손상과 폐쇄 외에도, 시술 다음 날 혈전색전증에 의해 좌전하행지가 막힌 경우도 있었다[70]. 급성 관상동맥 폐쇄의 빈도는 낮지만, 열손상과 이에 따른 재형성 과정이 관상동맥 협착을 일으킬 수 있음을 고려해야 한다. 가장 취약한 경우는 승모판막 협부 절제술 동안의 좌회선관상동맥으로 보인다[71]. 보호효과가 있는 심외막 지방증의 정도, 관상동맥 혈류량, 절제술의 강도와 시간 등이 심방세동 절제술 동안 관상동맥 손상과 관련된 몇 가지 결정인자들이지만, 가장 중요한 것은 관상동맥 주행에 인접한 위치에서 절제술을 하는 것이다. 이런 위치 근처에서 절제술을 할 때에는 신중한 감시와 고에너지 전달을 피하는 것이 동맥 손상 위험을 최소화하는 방법이겠다.
심방세동 카테터 절제술 동안 방사선 노출
중요하지만 쉽게 간과하고, 잠재적인 심방세동 절제술의 합병증으로 잘 고려하지 않는 것이 환자에게 노출된 방사선의 지연 효과인데, 여기에는 급성 혹은 아급성 피부손상, 암, 유전 이상 등이있다. 투시검사는 카테터 거치, 관상정맥동 안에 다전극 카테터 위치시키기, 2차례 중격경유 천자 및 카테터삽입, 폐정맥 혈관조영술, 좌심방 절제술 등 시술 대부분에서 필요하다. 한 연구에서는 50-60개의 선량계를 부착한 조끼를 입고 peak skin doses (PSDs)를 측정했을 때, 평균 투시검사시간 67.8 ± 21분에서 평균 PSDs가 우전경사각도에서는 1.0 ± 0.5 Gy를 좌전경사각도에서는 1.5 ± 0.4 Gy를 보였다. 투시검사 60분을 기준으로 암이 발생할 평생 위험도는 여자는 0.07%, 남자는 0.1%로 예측하였다[72]. 최근에는 3차원 지도 시스템과 카테터 접촉력 감시가 가능하면서 투시검사 시간이 의미 있게 감소하였다[73]. 시술자와 납가운에 가려지지 않는 부분에 대해 방사선 노출을 최소화하기 위해서는 방사선 차단 캐빈(cabin)을 쓰거나 매달린 납가운을 쓰는 법도 있다[74]. 최근에는 폐정맥 격리술을 투시검사 없이 혹은 최소한만 쓰고 하는 방법이 보고되고 있다. 투시검사 없이 안전한 카테터 조작을 위해서는 심장 내 초음파와 컴퓨터 단층촬영 혹은 자기공명영상을 이용한 영상 통합이 필요하다[75].
심장막염
심방세동으로 카테터 절제술을 받은 환자의 50% 이상이 시술 후 처음 수일간 흉막성 가슴통증을 호소하며, 또한 경미한 심장막삼출을 절제술 후 흔히 볼 수 있다. 이런 절제술 관련 심장막염은 매우 흔하고 대부분 저절로 호전되며 예후에 거의 영향이 없으므로 시술 합병증으로 보기보다는 심방세동 카테터 절제술의 기본 임상 과정 중 한 부분으로 생각한다. 그러나 이런 환자의 일부에서는 임상적으로 의미 있는 더 심한 심장막염으로 진행하는데, 최근 다기관 분석에서는 0.1-0.6%의 빈도를 보고하였다[76]. 심방세동 카테터 절제술 동안 전층 병변이 만들어지므로 어느 정도 심외막 염증과 이로 인한 심장막염은 필연적이다. 그러나 더 광범위한 심장막염은 급성으로 혹은 좀 시간이 지나서 심방세동 카테터 절제술의 합병증으로 발생하여, Dressler 증후군, 지연된 심장눌림증, 그리고 협착심장막염 등이 된다[77]. 심장막염의 심한 증상과 결과는 시술 후 18일에서 3개월 사이 나타나는데 심방세동 절제술 후 조기 퇴원하는 일반적인 관행으로 시술 후 조기 심장막염 발생을 더 적게 예측할 수 있다. 비스테로이드 소염제나 스테로이드가 심방세동의 재발을 예방한다는 증거는 현재 없다. 소량의 hydrocortisone (100 mg)을 1회 주사했을 때 심장막염은 2.5%에서 1.1%로 줄였다는 연구가 있었으나, 심방세동의 조기 및 후기 재발과는 관계가 없었다[78]. 다른 연구에서도 소량 (hydrocortisone 100 mg)및 중등도 양 (methylprednisolone 125 mg)의 스테로이드 1회 주사도 심방세동 재발을 줄이지는 못했음을 보고하였다. 구체적인 자료는 부족하지만 콜히친은 현재 심방세동 절제술 후 심장막염 치료의 기본이다. 한 연구에서는 콜히친을 3개월(0.5 mg 1일 2회) 복용한 군과 대조군을 무작위 배정한 결과 콜히친군이 의미 있게 심방세동 조기 재발률이 감소했음을 보여주었다 (16% vs 33.5%). 이는 IL-6와 C-반응성 단백질 같은 염증 매개체의 감소와 강력하게 관련이 있었다. 15개월 뒤에도 심방세동 재발률의 상대위험도 33.7% 감소가 보였다[23]. 장기간 재발률도 콜히친 31% 대 대조군 49%로 콜히친군이 낮았다. 콜히친은 또한 삶의 질의 개선 효과도 보였다[79].
승모판 외상과 원형 카테터 포착(entrapment)
심방세동 절제술 중 원형 다전극 지도 카테터(circular multielectrode mapping catheter)가 승모판에 포착되는 것은 흔하진 않지만 알려져 있는 합병증이다. 이는 원형 전극 카테터를 왼쪽아래 폐정맥에 위치시키려고 하거나 혹은 좌심방의 전기해부지도를 만들던 중 승모판 주변이나 좌심실로 의도치 않게 들어간 경우 발생한다. 이 합병증은 카테터를 다른 폐정맥으로 옮기려고 할 때 저항이 느껴지면 의심해 보아야 하고, 의심될 경우 심초음파로 확진해야 한다. 부드럽게 카테터를 시계방향으로 돌리거나 쉬스를 심실까지 밀어서 카테터를 회복한 케이스도 있지만, 그런 시도를 하던 중 승모판이나 유두근(papillary muscle)을 손상시킨 보고도 있다[22]. 카테터 제거 시동 중 카테터 끝이 부러져 올가미나 수술로 제거한 경우도 있어, 부드럽게 카테터 복구를 시도해보고 안되면 수술적 제거가 권고된다. 곡선 카테터를 승모판에서 떨어져 안전하게 두는 것이 중요하고 카테터는 시계방향으로만 힘을 주고 특히 왼쪽아래 폐정맥에 접근할 때는 주의가 필요하다. 인공판막을 가지고 있는 환자에서 심방세동 절제술 결과는 자료가 제한적이다. 한 작은 연구에서는 장기간 결과는 유사하나, 승모판 혹은 대동맥판 치환술을 받은 환자에서 더 긴 시술시간과 더 많은 시술 합병증 발생을 보고하였다[80]. 인공 승모판막이 있는 환자에서 심방세동 절제술 후 새로운 판막주위 누출을 보고한 경우도 있어 이런 환자에서 판막 주위 절제술을 할 때 특히 주의가 필요하겠다[1].
심방세동 절제술의 사망 위험도
심방세동 절제술은 일반적으로 안전하지만, 심각하고 치명적인 합병증이 드물게 발생한다. 최근 보고에 따르면 전세계적으로 심방세동 절제술을 받은 환자 32,569명 중 32명 (1,017명 중 1명)의 사망을 보였다[81]. 가장 흔한 사망원인은 25%를 차지한 심장눌림증이며, 이 중 3%는 시술 후 30일이 지나서 발생하였다. 뇌졸중이 16%를 차지했고, 이 중 6%가 30일이 지나서 생겼다. 심방식도누공이 16%, 광범위한 폐렴이 6%를 차지하였다. 시술 관련 흔하지 않은 원인으로는 심근경색, 비가역적인 Torsades de pointes, 패혈증, 급성 호흡정지, 심낭외 폐정맥 천공, 양쪽 폐정맥 폐쇄, 혈흉, 아나필락시스가 각각 3% 정도를 차지하였다. 모든 사망의 22%가 시술 후 30일이 지나서 발생하였다. 확인된 후기 사망 원인은 쇄골하 혈종에 의한 이차적인 기도폐쇄에 의한 질식, 두개내 출혈, 급성호흡부전 증후군, 수술 중 경식도심초음파에 의한 식도천공이 각각 3% 정도를 차지하였다. 이 결과들은 대부분 숙련된 시술자와 시술병원들의 결과로 실제 빈도는 더 높을 것으로 생각된다. Medicare자료에서 본 심방세동 절제술의 30일째 모든 원인의 사망률(all-cause mortality)은 125명당 1명 (평균연령 72세)이었다[1].
경직 좌심방 증후군(stiff left atrium syndrome)
경직 좌심방 증후군은 1988년 승모판막 수술 후 처음 알려졌고 2011년 좌심방 카테터 절제술의 드문 합병증으로 인식되었다. 한 초기 연구에서 수 차례 수술적 좌심방 절제술을 받은 3명의 환자에서 설명이 안 되는 운동성 호흡곤란, 좌심방 고혈압, 좌심방압과 폐동맥쐐기압의 큰 V파를 보고하였다[82]. 이후 1,380명의 절제술을 받은 환자들을 대상으로 한 전향적 연구에서, 의미 있는 승모판 질환이나 페정맥 협착이 없는 19명 (1.4%)에서 새로 생겼거나 악화된 폐고혈압, 좌심방 이완기능장애가 있었다.
경직좌심방증후군은 또한 maze수술 이후에도 보고되었다. 작은 좌심방 크기 (≤45 mm), 높은 좌심방압, 심한 좌심방 흉터형성(scarring, >60%), 당뇨, 수면무호흡증이 폐고혈압과 경직좌심방증후군의 독립적인 예측인자로 확인되었다[83]. 또한 다른 연구에서는 절제술을 많이 할수록 이완기 기능장애가 더 심해질 수 있음도 보고하였다[84]. 다행히 경직좌심방증후군은 대체로 이뇨제 치료에 반응이 좋은 것으로 생각된다[83]. 경직좌심방증후군 혹은 악화된 폐고혈압은 심방세동 카테터 절제술을 받은 환자의 1.4-8%에서 발생하는 것 같다. 심방세동이나 혹은 좌심방 절제술 후 설명 안 되는 호흡곤란이나 우심부전 징후가 있을 때 경직좌심방증후군 가능성을 찾아보아야 한다. 진단은 좌심실 기능은 양호하지만 우심부전 징후와 폐고혈압 (평균 폐동맥압 >25 mmHg 혹은 운동할 때 >30 mmHg)과, 폐모세혈관쐐기압이나 좌심방 압력에서 큰 V파 (≥10 mmHg)가 있고, 의미 있는 승모판 질환이나 페정맥 협착이 없는 경우이다. 경직좌심방증후군의 위험성을 줄이려면, 작은 좌심방 크기, 높은 좌심방압, 심한 좌심방 흉터, 당뇨, 수면무호흡증이 있는 환자에서 광범위한 좌심방 절제술은 신중하게 고려할 것을 권고한다.
기침
기침은 심방세동 카테터 절제술 후 발생할 수 있는 특이 호흡기 증상으로, 기저 폐정맥협착, 횡경막신경 마비, 직접적인 기관지 손상, 경직 좌심방 증후군, 위식도역류, 폐색전증, 심장막염, 혹은 인공호흡기 관련 폐렴이나 시술 후 흡인성폐렴 같은 의인성 호흡기 합병증의 징후일 수 있다. 시술 후 기침의 빈도나 기전에 대한 자료는 부족하지만, 기저 기전은 절제술 방법에 따라 다를 수 있다. 고주파 절제술 후 기침은 고주파에 의한 폐정맥협착이 있음을 시사할 수 있다. 경한 폐정맥 협착은 대개 무증상이지만, 광범위한 심한 페정맥협착이 있는 경우 기침, 호흡곤란, 흉통 혹은 객혈을 호소할 수 있다[33]. 기침은 또한 비록 빈도는 드물지만(0.48%) 고주파에 의한 횡경막 신경 손상 징후일 수도 있는데, 손상 즉시 호흡곤란, 기침, 딸꾹질을 보이고 갑작스런 횡경막 상승을 동반할 수 있다[85]. 기침은 냉각풍선 절제술에서 더 흔하게 발생한다. 냉각풍선 절제술을 받은 6명 중 1명에서 마른 기침이 발생하였고, 91%에서 저절로 호전되었다[86]. 시술 후 기침의 가장 명백한 기전은 냉각풍선 절제술에 의한 횡경막 신경 손상이나 (11%까지 보고됨), 다른 연구는 냉각풍선 절제술에 의한 직접적인 상기도 자극이 기침을 유발함을 보고하기도 하였다.
심박수 증가와 동성 빈맥
일부 환자들은 심방세동 절제술 후 안정 때 심박수의 의미있는 증가를 경험할 수 있다. 보통 10-20회/분 정도 빨라지는데, 소수에서는 100회/분을 넘길 수도 있다. 이런 현상은 절제술 때 폐정맥방 근처에 있는 신경얼기를 절제함으로써 자율신경 긴장도를 변화시킨 것과 관련이 있다[87]. 이런 신경얼기 절제술 후 나타나는 심박수 증가와 심박 변이성 감소 같은 부교감신경 위축징후는 시술 성공과 관련된다. 보통 3개월 정도 뒤 이런 징후는 회복되는데, 장기간 이런 자율신경 변화가 지속될 경우는 더 좋은 임상결과를 보인다는 연구도 있다[88]. 따라서, 절제술 후 심박수 증가는 정상 소견이며 긍정적인 임상경과일 수 있으므로 그 자체를 시술 합병증으로 봐서는 안 되겠다.
IV. 수련 요건
개요
공심방세동 절제술과 관련된 전략 및 기술은 지속적으로 진화하고 있다. 따라서, 이러한 시술을 수행하기 위한 수련 지침은 현장의 다양한 변화를 수용하기 위해 유연할 필요가 있다. 심방세동 절제술 수행을 위한 수련은 6가지 기본 원칙을 포함해야 한다: (1) 적절한 환자 선택; (2) 심방 및 인접 구조물의 해부학 지식; (3) 심방세동 절제술 전략의 개념적 지식; (4) 기술적 능력; (5) 합병증의 인지, 예방 및 관리; (6) 적절한 추적관찰 및 장기 관리. 심방세동 절제술은 다른 절제술과 비교하여 기술적으로 더 어렵고 위험도가 크며, 더 세심한 후속 조치가 필요하기에 각 영역들에서 요구되는 수련 요건은 다른 절제술과는 다소 차이가 있다.
적절한 환자 선택
수련생은 중격경유 천자의 난이도 및 시술 위험도를 높이고, 단기 및 장기 결과에 영향을 미칠 수 있는 임상 인자들이 무엇인지 알아야 한다. 수련생은 의식하 진정 및 또는 전신 마취가 환자에게 적절한지 판단할 수 있어야 한다. 심방세동과 관련된 증상의 중증도 및 절제술의 잠재적 이점을 평가하는 것도 중요하다. 수련생은 절제술 및 그 대안의 잠재적 위험 및 이점에 대해 환자에게 적절한 상담을 해줄 수 있어야 하고, 이러한 지식을 활용하여 개별 환자의 요구에 맞춰 적절한 치료법을 추천할 수 있어야 한다. 심방세동 절제술의 약리학적 대안도 고려해야 한다. 카테터 절제술을 수행하는 전기생리학자는 심방세동의 수술적 절제술에 대해서도 잘 알아야 한다. 특히, 심방세동 절제술을 수행하는 전기생리학자는 심방세동 절제술의 수술적 절제술의 적응증, 방법 및 임상결과에 대해 알고 있어야 한다. 이는 새로운 최소 침습 수술 방법 및 다른 심장 수술과 함께 진행되는 심방세동 절제술, 그리고 Cox-Maze III 수술에 모두 적용된다.
심방 및 인접 구조물의 해부학 지식
좌심방 및 그 주변 구조의 해부학적 지식은 중격경유 천자 및 쉬스 삽입, 좌심방 지도화 작업, 폐정맥 격리 또는 substrate modification을 수행하는데 기술적 측면에서 매우 중요하다. 수련생은 심방, 상대정맥, 폐정맥들의 해부학적 관계를 폐동맥, 대동맥, 승모판륜, 가로막신경, 교감/부교감 신경지배, 식도 및 다른 종격동 구조와 연관 지어 인지할 필요가 있다. 이러한 해부학적 관계는 시술을 성공적으로 수행하고 합병증을 예방하는데 영향을 준다.
심방세동 절제술 전략의 개념적 지식
수련생은 심방세동의 병태생리 및 이러한 내용이 심방세동 절제술에서 내포하는 의미를 이해해야 한다. 이는 폐정맥, 상대정맥, 좌심방 심근의 역할 및 자율 신경 자극의 잠재적 영향을 포함한다. 수련생은 폐정맥 격리술 및 심방세동 촉발 초점 제거의 이론적 근거와 함께, 조직의 광범위 원형 절제, fractionated potential의 제거 및 심방세동을 유지시키는 기질을 변화시키는 것으로 생각되는 다른 기술들의 이론적 근거들을 이해해야 한다.
기술적 능력
심방세동 절제술의 기술적 요구사항은 상당히 많다. 이는 항응고 관리, 중격경유 천자 및 좌심방으로 쉬스 삽입, 맵핑 및 절제술을 위한 카테터의 정확한 조작, 폐정맥 입구의 구별, 절제술에 사용되는 에너지의 조정, 방사선 투시, 조영제, 3D 지도화 장비 및 심장 내 초음파의 적절한 사용을 포함한다. 시술을 배우는 초기 단계 수련생들이 기본 기술을 습득하거나 심장눌림증과 같은 급성 합병증을 빠르게 인지하고 대처하는데 도움을 줄 수 있는 시뮬레이션 기술들이 발전하고 있다[1-3]. 방사선 조영 영상, 전기해부학적 지도화(electroanatomical mapping) 또는 심장초음파의 활용을 비롯하여, 절제술을 수행하고 전기적 시술 종료점을 식별하는데 사용하는 카테터의 종류 및 개수는 검사실마다 큰 차이가 있다. 따라서 특정 기술을 사용하여 얻는 전문 지식의 정도는 수련 기간 및 장소에 따라 달라질 수 있다. 그럼에도 불구하고, 수련생은 여러 시스템들의 잠재적 이점과 한계를 이해하고, 이러한 여러 기법에서 얻어진 기본 영상 및 전기신호기록을 해석할 수 있는 능력을 갖추어야 한다. 또한 환자와 절제술을 수행하는 의료진의 방사선 안전 원칙에 정통해야 한다.
수련 프로그램은 폐정맥 전기 신호를 인식하고 폐정맥의 전기적 절연이 언제 이루어졌는지를 결정하기 위한 심장내 전기신호의 해석, 폐정맥 신호와 원위부 신호를 감별하기 위한 관상정맥동 및 좌심방이 조율의 역할, 좌심방의 fractionated low-amplitude potentials, 심방빈맥 또는 심방조동의 지도화 및 절제를 위해 필요한 기술을 강조해야 한다. Entrainment와 관련된 개념이 특히 중요하다. 수련생은 방실결절회귀성빈맥, 방실회귀성빈맥과 같이 심방세동을 촉발시킬 수 있는 다른 상심실성 빈맥의 존재, 기전, 및 발생부위를 확인하고 절제하는데 숙련될 필요가 있다. 고주파 도자절제술의 훈련 및 숙련은 매우 중요한데, 전형적, 비전형적 심방조동의 절제술에 이러한 절제 기술이 필요하기 때문이다. 또한 많은 전기생리학검사실에서 심방세동 절제술에 고주파 에너지를 사용하고 있다. 많은 다른 전기생리학자들은 냉각풍선 절제술을 선호하기도 한다. 현재 일부 지역에서 활용 가능한 다른 절제술로는 레이저 풍선 절제술, 원형 다극 고주파 절제 카테터 등이 있다. 한다. 수련생은 각 에너지원 및 관련 전달 시스템의 장점과 한계에 대해 잘 알고 있어야 한다.
시술 경험
2015년 미국심장학회(ACC/AHA/HRS)는 임상 심장 전기생리학 전임의 과정으로 최소한 국소 심방빈맥 5례, 거대회귀성 심방빈맥 30례 (20례의 협부 의존성 및 10례의 협부 비의존성/복잡 거대회귀성 심방빈맥을 포함), 심방세동 절제술 50례를 제안했다[4]. 2017년 미국심장학회 지침에서는 이에 더하여 매달 최소 수 건의 심방세동 절제술을 시행하여 숙련도를 유지할 것을 추천하였다. 이러한 숫자는 높은 수준의 숙련도에 필요한 경험을 과소 평가하는 측면이 있다[5-8]. 기술 향상의 속도는 차이가 있기 때문에 정확한 숫자를 제시하기는 어렵다. 그럼에도, 센터의 규모에 따른 비교 결과는 100례 이상을 수행한 기관에서 임상결과가 우수하다고 제시하였다[9,10]. 다른 자료에서는 연간 25례 이상의 시술자, 연간 50례 이상 수행하는 기관에서 향상된 임상결과를 보였다[11]. 더해서, 환자의 선택 및 심방세동 환자에서 흔히 관찰되는 심방조동과 다른 심방빈맥의 해석에도 특유의 전기생리학적 훈련이 필요하다.
합병증의 인지, 예방 및 관리
이전에 논의 된 바와 같이, 심방세동 절제술은 상당한 위험을 수반한다. 수련 프로그램은 이러한 위험을 줄이는 기술들을 강조해야 한다. 이는 주의 깊은 카테터 조작, 적절한 항응고제 사용, 좌심방 후벽부에 전달되는 에너지의 조절, 폐정맥 및 좌심방이 내부 에너지 적용의 위험성을 포함한다. 수련생은 저혈압의 흔한 원인으로 심장눌림증 및 내부 출혈을 의심하도록 훈련 받아야 한다. 심장눌림증이 의심될 때 응급 심초음파를 수행하는 기술은 매우 중요하다. 심낭천자술 수행 또한 수련이 필요하다. 수련생이 심낭천자에 숙달되지 못하다면, 심장눌림증을 인식, 진단하고 곧바로 응급 심낭천자술을 시행할 수 있는 의사에게 연락할 수 있어야 한다. 의식하 진정이 호흡저하, 흡인, 호흡정지와 같은 위험성을 동반함을 알아야 한다. 심방-식도 누공 또는 폐정맥 협착과 같은 지연 발생 가능한 합병증에 대한 인지 및 이러한 합병증의 적절한 진단 및 치료 단계 또한 알고 있어야 한다.
적절한 추적관찰 및 장기 관리
퇴원 후 환자 관리는 때로는 복잡하여 지속적으로 환자를 진료하는 의사(심장 전문의 또는 내과 의사)의 헌신이 필요하다. 심방세동 절제술을 수련받는 의사는 이러한 환자들을 추적하는 클리닉에 참여하여야 한다. 식도 손상, 폐정맥 협착 및 지연 심장눌림증, 가성 동맥류 또는 동정맥루 등의 시술 후 합병증의 진단 및 처치에 대한 경험을 가져야 한다. 이러한 합병증의 빈도가 매우 낮기 때문에, 수련생이 이러한 환자에 대한 직접 경험이 없을 수도 있다. 따라서, 절제술후 합병증의 진단 및 치료에 대한 교훈적 증례를 통해 임상 경험을 보완하는 것이 필요하다. 시술 후 심방 부정맥의 예방과 관리에 대한 교육이 필요하며, 이는 재시술의 시기 및 항부정맥제 사용을 포함한다. 마지막으로, 수련 과정은 중-장기 항응고치료의 위험-이득의 의사결정과정을 다루어야 한다. 이러한 사안들의 복잡성을 감안하여, 전기생리학에 대해 적절히 수련 받지 않은 심장전문의가 심방세동 절제시술을 수행하는 것은 바람직하지 않을 수 있겠다. 이러한 사안과 역량의 습득 및 유지를 위한 전제조건을 고려할 때, 이러한 권고는 냉각절제술 또는 기타 풍선 절제술의 수행에도 동일하게 적용될 수 있겠다.
V. 수술 및 하이브리드 심방세동 절제술
1. 심장 수술 시행하는 경우 심방세동 수술의 동반 적용
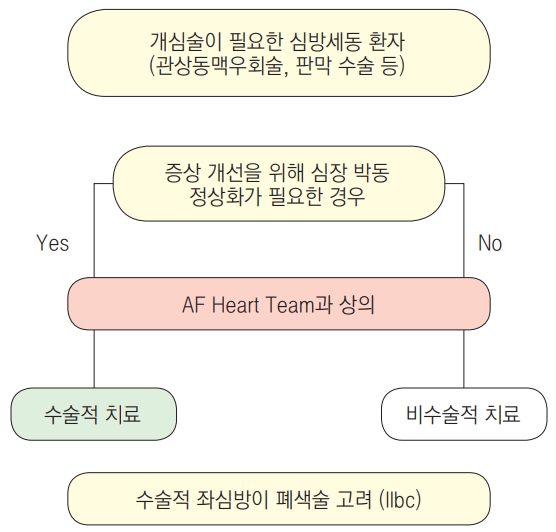
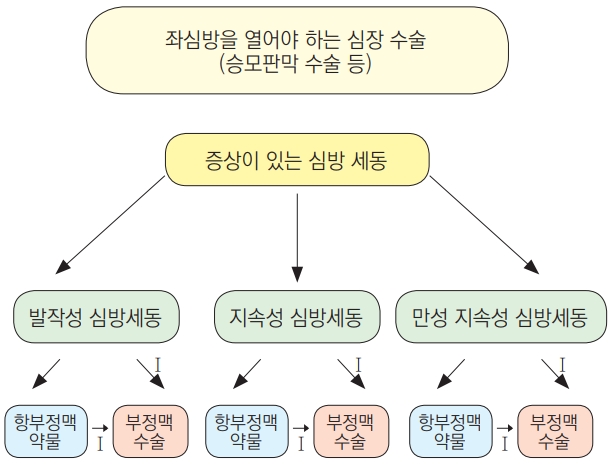
심방 세동의 수술적 치료인 미로 술식 (The Cox Maze procedure)은 30년 전 처음으로 도입되었다. 이 술식은 심방을 자르고 다시 봉합하는 이른바 “Cut-and-sew” 방식으로 매우 복잡하고 침습적임과 동시에 매우 효과적인 술식으로 알려져 있다. 절개 부위는 좌심방 후벽, 승모판막륜의 일부, 하대정맥-삼첨판막 연결부위, 상대정맥-하대정맥 연결부위이며 뇌졸중을 예방하는 차원에서 대부분 환자들에서 좌심방이를 절제하게 된다[31]. 이 술식의 원리는 동방 결절 (SA node) 에서 방실 결절 (AV node) 로 전기적인 통로를 단일화함으로써 micro-reentry를 차단하는 것이다. 전통적인 미로 술식은 정중 흉골 절개가 필요하고 수술 관련 합병증 발생율이 적지 않아 단독 심방세동 환자들보다는 판막 수술 등 다른 심장 수술을 시행할 때 동반 술식으로 주로 사용된다. 미로 술식 결과를 체계적으로 정리한 논문들에 의하면 미로 술식을 시행하는 경우 시행하지 않는 경우보다 심방세동, 심방조동 그리고 심방빈맥 등의 유병율이 크게 감소하였다 (RR 1.94; 95% CI 1.51–2.49; 7개의 무작위 전형적 연구) [32]. 다만, 미로 술식의 경우, 인공 심장 박동기 삽입율이 높았다. 이 결과는 미국 심장 학회의 대형 데이터 베이스를 통한 연구에서도 재차 확인되었다. 이 연구에서는 67,389명의 전통적인 개심술을 통한 미로 수술을 받은 환자들을 대상으로 하였는데, 수술 관련 사망률과 합병증은 수술 여부와 무관하였고 수술을 한 경우 인공 심방 박동기 삽입율만 높음을 보였다 (adjusted OR 1.26; 95% CI 1.07–1.49) [33]. 수술 후 심방 세동의 재발위험인자는 좌심방 크기가 큰 경우, 고령, 심방 세동의 유병기간이 10년 이상인 경우 그리고 만성 지속성 심방세동인 경우였는데 전통적인 미로 술식이 가장 효과가 좋았고 좌심방 술식만 하는 경우는 그 효과가 떨어졌다[34-37]. 동반 미로 술식이 장기 예후에 좋은 영향을 미치고 있음은 한국인을 대상으로 한 여러 국내 연구들에서도 밝혀졌다. 기계 판막을 이용한 승모판막 치환술에서 심방세동이 있는 경우 미로 술식을 시행하는 것이 환자의 증상 개선에 좋음은 물론 좌심방 수축 기능 회복으로 인해 뇌졸중 등 혈전 관련 합병증도 예방 가능함이 보고되었다[38-40]. 또한 좌심방이 매우 큰 경우, 심방 중격 결손과 연관된 경우, 좌심실 기능이 저하된 경우에서도 미로 술식이 임상적으로 어느 정도 효과가 있음이 여러 후향적 연구에서 밝혀졌다[41-44]. 비록 동반 미로 술식이 환자들의 장기 예후에 좋은 영향을 미칠 수 있으나 수술 자체의 합병증을 무시할 수 없으므로 수술 시행 여부에 관해서는 심방 세동 다학제 팀 (AF Heart Team) 내에서 충분한 상의 끝에 결정하는 것이 바람직하다. (Figure 1)
1.1 좌심방 절개가 필요한 개심술을 시행하는 경우
2009년 발표된 미로 술식에 관한 대표적인 논문에 의하면 좌심방 절개가 필요한 심장 수술을 시행할 때 미로 술식을 시행하는 경우 9%의 수술 합병증, 25%의 인공 심장 박동기 삽입이 발생하였고 12개월 심방 세동 회피율은 75%로 보고되었다[12]. 최근에는 여러 무작위 전향 연구를 비롯 메타 분석에서 동반 미로 술식의 안정성과 효과가 입증되었다. 좌심방 크기가 큰 경우, 심방세동의 유병기간이 긴 경우, 고령인 경우가 재발의 위험인자들로 밝혀졌다. 심장 수술을 하기에 고위험군인 경우 미로 술식을 하지 않기도 하지만 많은 센터에서 이러한 환자에서도 정상 박동이 가지고 있는 장점을 얻기 위해 시행하고 있다. 가장 최근 발표된 메타 분석 결과에 의하면 미로 술식의 효과와 안정성이 재차 확인되었고 놀랍게도 인공 심장 박동기 삽입율도 낮다고 하여 미로 술식의 인공 심장 박동기 삽입에 대해서 새로운 논란을 제기되고 있다. 장기 성적도 역시 미로 술식을 시행하는 것이 유리한 것으로 보이는데, 10년 이상의 임상 결과를 조사한 한 연구에서는 미로 술식을 시행하여 정상박동을 잘 유지하는 경우 그렇지 못한 경우에 비해 확실한 장기 생존율의 향상을 보였다고 한다[17,19]. 한편, 좌심방 크기와 심방세동 유병기간 외에도 성적에 관여하는 중요한 인자는 수술자의 숙련도이다. 심방세동의 정확하고 폭넓은 이해는 물론 미로 술식 자체에 대해서 제대로 교육 받은 후 시작하는 것이 추천된다. 결론적으로, 좌심방 절개가 필요한 심장 수술 (승모판막 수술) 의 경우 증상이 있는 심방세동이 있으면 미로 술식을 같이 시행하는 것이 추천된다(Class I, LOE B). (Figure 2)
1.2 좌심방 절개를 하지 않는 개심술을 시행하는 경우
좌심방 절개를 하지 않는 심장 수술은 대동맥 판막 수술, 관상동맥우회술 그리고 둘을 동시에 하는 경우가 포함된다. 이 환자들에서 심방세동이 동반된 경우 치료를 하지 않으면 조기 그리고 만기 임상 결과가 좋지 않다. 비록 미로 술식을 동반하는 것이 원칙적으로는 이득이 있으나 많은 수술자들은 굳이 추가적으로 좌심방을 절개하려 들지 않는데 이는 추가 절개로 인한 출혈의 위험이 증가하고 그만큼 수술 시간이 길어지기 때문이다. 최근에는 심방을 열지 않는 심장 밖에서 폐정맥 입구를 전기적으로 차단 (Pulmonary vein isolation) 하고 좌심방이 (left atrial appendage) 를 절개하는 등 간소화된 부정맥 수술을 시행하는 병원이 많아지고 있다[25-27]. 최근 발표된 전형적 무작위 연구에 의하면 대동맥 판막 수술과 관상동맥우회술을 시행하면서 미로 술식을 같이 하더라도 조기 성적이 하지 않은 경우와 차이가 없을 뿐 아니라 1년 심방세동 회피율이 월등하게 높은 것으로 밝혀졌다[28-30,45-50]. 하지만 대동맥 판막 질환 혹은 관상동맥질환이 있는 경우 심장 관련 증상이 심방세동 관련 증상과 비슷하여 부정맥 수술 시행 여부에 혼란을 가져올 수 있다. AF Heart Team을 결성하여 충분히 상의를 한 후 개개인의 Class I 선택을 하는 것이 바람직하다. 결론적으로 좌심방 절개가 필요 없는 대동맥 판막 수술, 관상동맥우회술 혹은 둘을 동시에 시행하는 경우에 증상이 있는 심방세동을 가진 환자에서 적어도 하나 이상의 Class I 혹은 III 항부정맥약물 치료가 듣지 않는다면 미로술식을 같이 시행하는 것이 추천된다(Class IIa, LOE-B). (Figure 3)
2. 단독 심방 세동 (stand-alone AF) 의 수술적 치료
1.1. 단독 심방세동의 수술적 치료
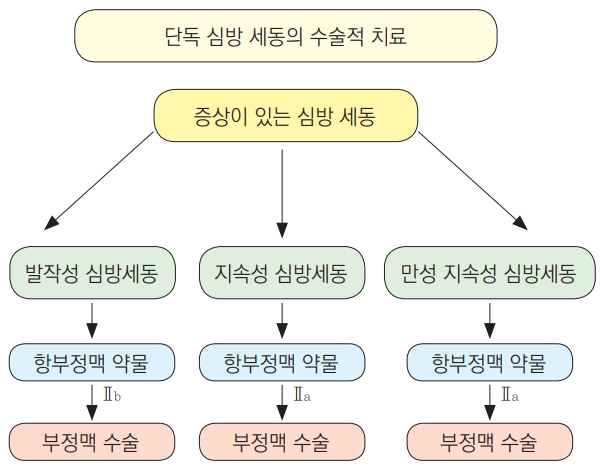
단독 심방세동의 수술적 치료의 적응증에 관해서는 2012년 채택된 합의서 (2012 Consensus Document) 에 명시되어 있다. 증상이 있거나 적어도 하나의 Class I 혹은 Class III 항부정맥약물이 듣지 않는 경우이다[66]. 최근에는 한 번이상의 전극도자술의 실패 병력있거나 환자 자신이 수술에 관해 강력한 의지가 있는 경우도 적응이 될 수 있다. 단독 심방세동의 수술적 치료는 20년전부터 시행되어 왔으나 수술의 침습성으로 인해 현재까지도 널리 시행되지 못하고 있다. 더군다나 수술자들간 수술 방법이 제각기 다를 뿐 아니라 수술 성적을 발표할 때도 보고서마다 재발의 기준이 모호해 비교 연구가 매우 어려운 실정이다. 뿐만 아니라 대부분의 부정맥 수술 관련 논문들은 환자 수가 많지 않을 뿐만 아니라 기존 술식과의 단순 비교가 대부분이고, 몇 안되는 다기관 연구도 비교군이 없는 경우가 대부분이라 적절한 가이드라인을 제시하는데 어려움이 있다. 단독 심방 세동의 수술적 치료에 관한 가장 대표적인 논문은 미로 술식 (Maze operation) 의 창시자 제임스 콕스 (James Cox) 가 발표하였다[53]. 112명을 대상으로 한 이 논문에서는 정중 흉골 절개하에 인공심폐기를 운용하고 심정지를 시킨 후 전통적인 방법인 “절개 후 봉합법”을 사용하여 미로 술식을 시행하였다. 승모판막륜 부위는 냉동소작기를 이용하여 차단하였다. 최종 추적 관찰 결과, 112명의 환자 중 96%에서 정상 박동을 보였고 항응고제를 쓰지 않는 경우는 80%로 매우 좋은 성적을 보였다. 뇌졸중은 1명에서만 발생하였고 88%의 환자들에서 항응고제를 중단할 수 있었다. 심방 세동의 재발의 유발 인자는 수술 전 심방세동의 유병 기간이 긴 경우였다. 이 후 비슷한 결과를 보이는 논문들이 뒤를 이었지만 전통적인 미로 술식은 그 복잡성과 수술의 난이도로 인해 널리 사용되지 못하였다.
그러던 중 미로 술식을 위한 새로운 에너지원들 (양극성 고주파 시스템, 초저온 냉동 소작 시스템) 이 도입되면서 단독 심방세동의 수술 방법이 크게 달라지게 되었다. 특히 침습도가 매우 낮아져 작은 절개창만으로 미로술식이 가능하게 되어 보다 많은 환자들에게 적용되기 시작하였다. Cox-Maze IV로 명명된 이 술식은 전통적인 미로술식의 절개 부위를 양극성 고주파와 초저온 냉동 소작기를 같이 사용하여 적은 절개창 및 짧은 수술 시간이 장점이다. 수술 후 조기 성적은 전통적이 미로 술식과 거의 동일한 것으로 알려져 있다. 146명을 대상으로 한 만기 성적 보고에서 5년째 심방세동 회피율이 72%였고 이 중 항부정맥약을 사용하지 않은 환자는 59%였다. 냉동 소작기만 사용한 경우는 77명을 대상으로한 조기 성적만 발표되었고 6개월 성공율이 88%였다[67].
2005년에 들어서 심장을 열지 않고 심방 외막을 통해 미로 술식을 시행하는 훨씬 더 비침습적인 미로 술식이 고안되어 사용되기 시작하였다[54]. 이 술식은 흉강경을 사용하여 절개창이 기존보다 훨씬 작거나 아예 없는 것이 특징이다. 양극성 고주파 겸자 (Bipolar RF clamp) 를 사용하여 인공심폐기를 사용하지 않고 박동하고 있는 심장에서 폐정맥 격리술 (Pulmonary vein isolation) 을 시행하고 좌심방이 (Left atrial appendage) 를 제거하는 술식이다. 조기 성적을 살펴보면, 23명 중 21명(91%) 가 3개월째 정상 박동으로 보였고 항부정맥제는 65%에서 사용하지 않았다. 이 술식을 100명에서 시행한 다기관 연구에서 13.6개월 추적 관찰 기간동안 87%의 환자에서 정상 박동이 유지되었고 이 중 항부정맥제는 64%에서 사용하지 않음이 보고되었다[57]. 하지만 최근 나오는 논문들은 지속성 심방세동 뿐 아니라 발작성 심방세동이 많이 포함되어있고 수술 시 시행하는 전기 차단 부위 역시 조금씩 달라서 그 효과를 제대로 비교하기 어렵다고 할 수 있다.
인공 심폐기를 운용하지 않는 최소 침습 미로 술식 중 대표적인 방법은 Dallas lesion set을 만드는 것이다[25-27]. 이 술식은 승모판막륜 부위를 제외하고는 전통적인 미로 술식과 유사하다. 심장 바깥쪽에서는 승모판막 후륜으로 접근하기가 어렵기 때문에 Dallas lesion set에서는 대동맥 판막륜과 승모판막 전륜간 연결부위에 병변을 형성하게 된다. 30명을 대상으로 한 조기 성적을 살펴 보면, 10명은 지속성 심방세동이고 20명은 장기 지속성 심방세동인데 6개월째 정상박동 유지율이 지속성 심방세동 환자들에서는 90%였고 장기 지속성 심방세동 환자들에서는 75%였다. 항부정맥 약물 치료는 지속성 심방세동 환자들에서는 22%, 장기 지속성 심방세동 환자들에서는 53%에서 필요하였다[25,26]. 이는 경피적 전극도자술과 유사한 결과로서 지속성 심방세동의 경우 유병기간이 길수록 보다 광범위한 병변이 장기 성적에 유리하다는 것을 시사한다.
경피적 전극도자술과 최소 침습 부정맥 수술의 임상 성적의 비교를 위해 The AF Catheter Ablation Versus Surgical Ablation Treatment (FAST trial) 이 시행되었다[52]. 총 124명의 심방세동 환자들이 대상이었는데 심방 비대가 있으면서 약물에 반응이 없거나 전극도자술 시행 후 재발한 환자들을 무작위 배정하여 비교하였다. 1년 추적 결과, 심방세동 회피율이 전극도자술의 경우 37%, 최소 침습 수술의 경우 66%로 좋았다. 수술 관련 합병증은 수술한 경우가 더 빈번하였으나 (34% versus 16%), 1명의 사망 환자는 전극도자술을 시행한 환자에서 나왔다. 이 후 7개 이상의 연구들 (무작위 연구 2건 포함) 에서 최소 침습 수술이 전극도자술 보다 낫다는 결과를 보였으나 연구들마다 수술 방법과 결과 보고 기준이 달라서 명백한 근거로서는 아직 부족하다고 할 수 있다[58]. 최소 침습 부정맥 수술에 관해서는 미국 흉부외과 학회 데이터베이스(STS database) 의 결과가 가장 보편적으로 인용되고 있다[59]. 이 데이터베이스에는 2005년부터 2010년까지 91,801명의 부정맥 수술을 받은 환자들을 포함하고 있는데 이 중 단독 심방세동 환자는 4893명 (5.3%) 이었다. 평균 나이는 60세이고 71%가 남자 환자였다. 80%의 술식이 심폐기를 사용하지 않고 시행되었고 수술 사망률은 0.74%로 보고되어 있다. 전체 수술 관련 합병증 발생률은 16%였지만 대부분 임상적으로 쉽게 해결되는 합병증들이 었고 중대 합병증의 빈도는 매우 낮아서 뇌졸중은 0.72%, 신부전은 2.45% 그리고 출혈은 0.99%였다. 이 중 인공 심장 박동기 삽입률은 1%밖에 되지 않았다. 합병증은 심폐기를 돌리는 경우가 더 높았다 (28% on pump versus 13% off pump). 표11 은 여러 문헌에 발표된 흉강경 부정맥 수술의 합병증 발생률을 정리한 것이다.
결론적으로, 발작성 심방세동의 경우, 환자가 한 번이상의 전극도자술을 실패한 경험이 있거나 충분한 정보 제공 후 환자가 적극적으로 수술적 치료를 원하는 경우 수술적 치료를 고려할 수 있다 (Class IIb, LOE B). 지속성 혹은 만성 지속성 심방 세동의 경우 역시, 환자가 한 번이상의 전극도자술을 실패한 경험이 있거나 충분한 정보 제공 후 환자가 수술적 치료를 선호하는 경우 수술적 치료를 고려할 수 있다(Class IIa, LOE B). (Figure 4).
1.2. 하이브리드 부정맥 술식
심방세동의 치료에서 경피적 전극도자술과 최소 침습 부정맥 수술을 경쟁적인 관점에서 바라보는 것이 아니라 상호 보완할 수 있다고 생각하는 상당 수의 미래 전향적인 임상의의 주장에 의해 최소 침습 부정맥 수술을 받은 만성 지속성 심방세동 환자들이 재발하는 경우 수술 전으로 돌아가는 것이 아니라 발작성 심방세동 수준이고 심방세동 부담 (AF burden) 이 매우 낮다는 것이 알려지게 되었다. 이러한 경우, 매우 간단한 전극도자술 (손을 대기만 해도 되는, Touch-up) 만으로도 정상 박동으로 성공적으로 전환시킬 수 있고 기존 어떤 방법보다 좋은 결과를 얻을 수 있다는 합의에 이르게 되었고 하이브리드 술식 개발의 배경이 되었다.
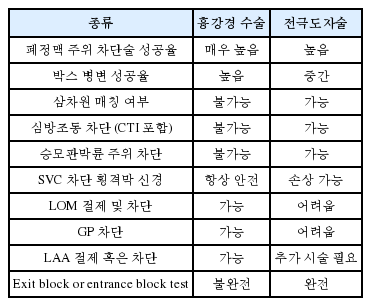
수술적 치료와 전극도자술의 상호보완역할은 표12에 정리하였다. 상호 보완을 거의 완벽하게 할 수 있는 이론상의 장점에도 불구하고 하이브리드 술식이 시작된지 얼마 되지 않아 그 효과와 안정성이 입증되지 않았고 또한 내과와 외과의 공조가 생각보다 쉽지 않아 널리 시행되고 있지 않은 실정이다. 하이브리드 술식에서 가장 관심이 모아지는 이슈는 바로 언제 전기생리학적 검사를 하느냐는 것이다. 최소 침습 부정맥 수술을 시행하면 전기적인 차단이 완전하지 않더라도 겸자에 의한 압력으로 세포의 기능이 일시 정지되거나(stunning) 부종이 발생하여 전기생리학적 검사상 위음성이 될 소지가 있다. 실제로 한 보고에 의하면, 부정맥 수술을 시행한 지 3개월 후 전기생리학적 검사를 시행했더니 폐정맥 차단술의 77-88%에서 전기 틈새 (Gap)이 발견되어 추가적인 전극도자술이 필요하였다[68]. 그럼에도 불구하고 이 보고서에서 1년 정상 박동 유지율은 90%여서 하이브리드 술식의 효과가 나쁘지 않음을 알 수 있다. 2018년에 발표된 메타 분석에서 16개 문헌에서 785명의 환자들이 대상으로 단계적 하이브리드 술식과 동시 하이브리드 술식보다 성공율을 비교하였다. 단계적 하이브리드 술식을 시행한 경우 성공율이 78%로 동시에 시행한 경우 (69%) 보다 좋았고 두 군 모두에서 조기 합병증은 낮음 (4%)을 보고하였다[69]. 국내에서는 흉강경 부정맥 수술이 2012년 최초로 시행되었고 수술 후 전기생리학적 검사를 시행하는 단계적 하이브리드 술식을 주로 시행하고 있다. 79명의 환자들을 대상으로 한 후향적 연구에 의하면 (지속성 심방세동이 90%) 단계적 하이브리드 술식의 2년 심방세동 회피율은 92.6% 였고 이 중 19% (15명) 에서 전기생리학적 틈새(Gap)가 확인되었다[70]. 가장 최근에는 흉강경 부정맥 수술을 시행한 172명을 대상으로 한 환자들 중 1년이 지난 후 심방 부정맥(atrial arrhythmia) 발생한 22명의 환자들에게 추가적인 전극도자술을 시행한 결과가 보고되었다[71]. 11명은 심방세동, 8명은 심방조동, 3명은 심방빈맥이었으며 17명의 환자들이 정상 박동을 다시 찾을 수 있었다. (Figure 5)
결론적으로, 하이브리드 술식은 그 중장기 성적이 충분하지 않고 기존 방법과 비교하는 전향적 임상 연구도 진행 중이다. The Dual Epicardial Endocardial Persistent Atrial Fibrillation (DEEP) trial 이 대표적인 다기관 연구이고 그 결과가 주목된다. 비록 하이브리드 술식이 지속성 혹은 장기 지속성 심방 세동에서 좋은 결과가 예상됨에도 불구하고 현재의 근거를 비추어 볼 때, 심방세동 환자가 수술적 치료가 필요한 경우에 고려 가능한 정도이다 (Class IIb, LOE C).
결론
심방세동 카테터 절제술은 전세계적으로 흔히 수행되는 시술이다. 심방세동의 수술적 절제술은 카테터 기반 절제술보다는 덜 사용되지만, 심방세동 환자에서 중요한 치료 선택지 중 하나이다. 본 지침은 심방세동 카테터 및 수술 절제술의 적응증, 기법 및 임상결과에 대한 최신 리뷰를 제공한다. 또한, 본 지침은 심방세동 절제술의 적응증, 시술 수행 기법과 수련에 대한 권고를 포함한다. 심방세동 절제술을 수행하는 사람뿐 아니라, 심방세동 환자를 진료하는 모든 사람들을 위한 기초를 제공함으로써 환자 진료를 개선하고자 하였다. 이 분야는 빠르게 발전하고 있으며, 따라서 본 지침도 업데이트가 필요할 것이다. 적절한 적응증, 시술 방법 선택 및 추적을 위해, 성공적인 심방세동 절제술 프로그램은 심장전문의, 심장전기생리학자 및 외과의사의 협력 팀으로 구성되어야 한다.