|
|
International Journal of Arrhythmia 2011;12(4): 4-9.
|

서론
제세동(defibrillation) 기전을 이해하기 위해서는 우선
심실세동(ventricular fibrillation, VF)에 대한 전반적인
이해가 필요하다. 즉 심실세동의 기본적인 전기적 특징이나,
심실세동이 유지되는 기전이 전기적 회귀(reentry) 혹은 국소적 활동성(focal activity)에 의한 것인지, 제세동 중인 심장 조직의 활동전위(action potential, AP)와
흥분도(excitability)는 어떠한 양상인지 등 광범위한 이해를 필요로한다.
심실세동의 양상
심실세동은 발생 후 심전도와 심실 수축 양상에 따라 총 4기로 분류한다.1 제 1기는 심실세동 발생 후 첫 1~2초간을 말하며 3~6번의 거의 정상에 가까운 심실 수축을
보인다. Undulatory 혹은 tachysystolic stage라고도 한다. 이어 나타나는 2기는 심실의 작은 영역들이 각자 수축하는 양상으로 경련이 일어난 것처럼 보이기 때문에 convulsive
incoordination으로 표현된다. 체내 제세동기(implantable
cardioverter defibrillator) 치료는 심실세동 발생 후 보통 10~20초 지난 후 이루어지는데 이 시기에 해당된다. 제 3기는 심실이 떠는 양상으로 보이는데 4기가 나타나기 전까지
2~4분 정도 지속되며 tremulous incoordination으로 표현된다. 이어 4기인 atonic fibrillation이 나타나는데 아주
미미한 전기파가 작은 영역에서 느리게 전도되는 양상이다.
심근허혈이 심실세동 발현 후 3~4기로의 진행에 중요한 역할을 하는 것으로 알려져 있는데 동물실험에서 관상동맥에
산소를 공급해주면 심실세동이 2기에서 더 진행되지 않고 계속 유지되는 것이 관찰되었다.2
심실세동의 발생과 지속 기전
심실세동은 여기저기 떠돌아 다니는 wavelet의 회귀에
의해 지속된다는 가설이 여러 연구에서 제시되었다. 이러한
wavelet의 멋대로인 움직임 속에서 어느 정도 조직화(organization)된 양상을 관찰할 수 있는데 이를 설명하는
가설로 ‘mother rotor' 가설과 ‘restitution' 가설이 있다.
‘Mother rotor' 가설은 심실에서 전기적 활동도가 가장
빠른 부위에 하나의 고정된 회귀 회로 즉 mother rotor가
있고 여기서 activation front가 다른 부위로 퍼져나가 일방향차단(unidirectional block) 지역을 만나면 보다 작고
이동 속도가 느린 wavelet으로 쪼개진다는 가설이다.3 하지만 이 가설은 guinea pig나 토끼와 같이 크기가 작은 심장에서는 증명되었으나 큰 심장에서는 명확히 입증되지 않았다.
심장의 restitution은 활동전위기간(action potential
duration, ADP)과 직전 이완기간(diastolic interval)과의
상관관계를 나타내는 개념으로 이완기간이 짧으면 활동전위기간이 짧고 이완기간이 길면 활동전위기간이 길다.
이들 관계를 restitution curve로 나타낼 수 있고 이 curve의 기울기가 클수록 심실세동의 유발과 유지가 용이하다고 알려져있다.4 하지만 이 가설은 율동 리듬에서는 잘 증명되었으나
심실세동에서는 그렇지 못하다. 따라서 두 가설 모두 심실세동의
유발과 유지하는 기전을 완벽하게 설명하지는 못한다.
이 두 가설을 실제 임상에 적용해 보면 심실세동이
mother rotor에 의해 유지된다면 전기 충격이나 심박동기율동을 mother rotor 부위에 가하여 심실세동을 성공적으로 제세동할 수 있을 것이고 restitution에 의한 것이면
restitution curve의 기울기를 감소시킬 수 있는 약을 투여하여 성공적인 제세동을 할 수 있을 것이다.
제세동의 기전
제세동의 기전에 대해서 지금까지 많은 연구가 진행되어
왔으나 모든 현상을 설명할 수 있는 기전은 아직 정립되지 못했다. 하지만 비약적인 연구 기기의 발전으로 여러 어려운 가설들을 설명할 수 있게 되었고
획기적인 새로운 가설의 등장도 기대된다. 제세동의 기전을 이해하기 위해서는 우선 취약성의 상한계(upper limit of vulnerability, ULV)와
제세동 역치(defibrillation threshold, DFT)에 대한 이해가 필요하다.
1. ULV와 DFT의 정의
심장에 전기충격(electrical shock)을 가할 때 심실세동이 유발될 수 있는 심장주기 중 일정 기간을 shock에 대한
취약기간(vulnerable period)이라고 한다. 이는 활동전위의 상대적 불응기(relative refractory period)에 해당하며5
심전도에서는 보통 T파의 정점을 기준으로 ±20 ms에 해당하는 구간이다.6 ULV는 취약기간에 shock을 가했을 때 심실세동이
유발되지 않는 가장 낮은 전기에너지로 정의되며
놀랍게도 이 개념은 이미 19세기에 정립되었다.7 DFT는 제세동이 가능한 최저에너지로 정의되며 ULV와 DFT는 통계적으로 서로 밀접한 상관관계가 있고 보통 ULV가
DFT보다 낮다.8, 9
따라서 전기충격을 심장에 가했을 때 심실세동이 유발되기 위해서는 심실세동을 유발시킬 수 있는 가장 낮은 에너지인 VF threshold와 ULV 사이에 해당하는 적당한 전기에
너지가 필요하며 shock은 반드시 심장주기 중 취약기간에
가해져야 한다. X축에 취약기간, Y축에 shock 에너지를 놓고 심실세동의 유발이 가능한 영역을 나타내면 VF zone을 그릴 수 있다(Figure 1).

2. ULV와 DFT에 대한 가설
1980년대 초 Winfree는 전기충격에 의해 VF가 유발되기 위해서는 적절한 refractoriness와 전기충격에 의한 voltage gradient로 만들어지는 시공간적 개념의
‘critical point' 가필요하며 이를 중심으로 일방향차단과
회귀가 발생한다고 하였다.10 이 critical point는 전기충격 에너지의 세기가 VFT에서 ULV로 상승함에 따라 전기충격을 가하는 전극으로부터 점점 멀어지며 ULV에 도달하거나
ULV를 넘어서게 되면 심실 전체를 벗어나 심실세동을 유발할 수 없게 된다.11
이후 optical mapping system을 이용한 연구에서
critical point는 전기충격에 의해 형성되는 가상전극(virtual electrode)에 의한‘phase singularities' 로 설명 되었다.12 Phase singularities는 완전한 탈분극에서부터
완전한 재분극까지 모든 phase가 연속되어 공존하는 상태를 말하며 회귀 발생의 중심이 된다.
전기파(electrical wave)는 활동전위의 upstroke 즉
phase 0에 해당하는 ‘wavefront' 와 rapid repolarization 즉 phase 3에 해당하는‘waveback' 으로 구성되어 있으며
wavefront와 waveback 사이의 길이인 wavelength (WL)는 활동전위기간과 전도속도(conduction velocity, CV)로
결정된다(WL = APD × CV). 따라서 정상적으로 전기파가
심장조직을 지나갈 때 wavefront와 waveback이 만나는 것은 불가능하다. 하지만 ‘wavebreak' 가 발생하면 이 둘이
접할 수 있게 되고 optical mapping study에서 phage singularities의 양상을 보인다.
3. ULV Hypothesis of Defibrillation
이 가설은 심실세동이 지속되어도 심실에는 지엽적으로
취약기간이 존재하며 심실세동 중 ULV와 정상 박동일 때의
ULV가 거의 일치한다는 내용이다.8, 13 성공적인 제세동을 위해서는 shock으로 VF의 모든 wavefront를 차단해야 하고
또한 재발이 없어야 되므로, 전기충격 에너지는 적어도 심실세동의 ULV이상이어야 한다. 따라서 VF시의 ULV는 VF의
모든 wavefront를 차단할 수 있는 전기충격 에너지 보다 작아야 한다. ULV hypothesis에서 DFT 바로 아래의 에너지 세기로 제세동 전기충격을 가했을 경우 심실세동을
종료시킬 수 없고 같은 에너지로 정상 박동이나 조율 박동 시 취약기간에 전기충격을 가했을 때 심실세동이 유발되는 것으로 보아
ULV와 DFT 사이에는 어떤 공통된 기전을 공유하고 있음을 유추해 볼 수 있다.
제세동 실패의 기전
제세동 실패의 기전(mechanism of failed defibrillation)은 아직까지 완전히 밝혀지지 않았다. 대표적인 가설로는 앞에서 언급한 ‘critical point' 가설과 ‘virtual
electrode' 가설이 있다. critical point 가설은 제세동 후 심실세동의 재발 여부는 전기충격에 의해 생긴
voltage gradient와 local refractoriness의 critical value가 동일 시공간에서 일치하느냐 않느냐에 따라 결정된다는 가설이다.14‘Virtual electrode' 가설에 의하면
ULV보다 강한 전기충격이 심장에 가해졌을 때
‘deexcitation' 다른 표현으로‘hyperpolarization' 즉 활성화되지 않은 평상시 막전위(membrane potential)보다 더 음전압화(negative polarization)된 부분이 발생하여
virtual anode를 형성한다. 이 부위에서의 wavefront의
진행 속도는 매우 빨라 virtual cathode 즉 탈분극된 주위 심근세포가 다시 회복하기에는 시간이 충분하지 않다. 따라서 심실세동의 재발에 관여하는 회귀가 형성될 수 없어 제세동에 성공한다. 반면에 shock에너지가 충분하지 않을 때는
회귀 기전에 의해 심실세동이 재발한다는 내용이다.15 하지만
모든 wavefront를 없애기에 충분한 에너지의 강한 shock이 가해졌음에도 불구하고 critical point가 형성되어 심실세동이 재발하는 경우가 종종 있고,
전기충격 후에 일시적으로 심실세동이 종료된 상태인 ‘isoelectric window' 를 거친
후 심실세동이 재발하는 경우 microreentry가 아니라 국소적인 breakthrough 형태로 나타나므로 제세동의 실패 기전을 위 두 가설만으로는 충분히 설명할 수가 없다. 따라서 ULV
가설과 연계하여 ‘triggered activity' 나 ‘progressive
depolarization' 이 제세동 실패의 기전으로 제시되기도 하였다.
최근에는 심근섬유의 방향(myocardial fiber orientation)이 ULV를 결정하는 중요 기전임이 컴퓨터 시뮬레이션으로
증명되었다. 심근섬유의 특정 배열 각도에 의해 국소적 비균질성(inhomogeity)이 형성되면 ULV가 존재하지만 민무늬
근육섬유(smooth muscle fiber)의 형태로 시뮬레이션하면
전기충격의 세기에 상관 없이 wavefront는 퍼져나가고 회귀를 유발하는 것이 관찰되었다.
따라서 심근섬유방향의 비균질성이 ULV와 제세동의 기전에 중요하게 관여함을 알 수 있다.16
제세동과 칼슘 역학(Calcium dynamics in Defibrillation)
칼슘은 심장의 excitation-contraction (E-C)
coupling에 관여하여 myofilament activation을 유발하고 ionic currents를 조절하여 정상 박동이나 치사성 부정맥을 일으키기도 한다.
Ca2+이 Ca2+ current (ICa)에 의해 세
포 내로 유입되면 sarcoplasmic reticulum (SR) 표면에
있는 ryanodine receptors (RyRs)를 통해 Ca2+ release를
유발하여 심근수축이 일어난다. 심근이완은 세포질 내의
Ca2+이 SR Ca2+ ATPase (SERCA)에 의해 다시 SR 내로
유입되거나 Na+ -Ca2+ exchange에 의해 sarcolemmal
membrane을 통해 세포 밖으로 나가면서 일어난다. 두 종류의 ICa가 심근세포 내에 존재하는데 membrane
potential (Vm) >-40 mV에서 활성화되는 L-type (ICaL)
과 Vm >-60 mV에서 활성화되는 T-type (ICaT)이 있다.
Inward ICaL와 ICaT는 심장의 정상적, 비정상적 탈분극에 중요한 역할을 하고 ICaL는 모든 심근세포의 E-C coupling에
필수적으로 관여한다. 반면에 ICaT는 심실근육세포에는 없고
신생아의 심실세포나 심방근육세포, 전기자극 전달이나 조율(conducting and pacemaker) 세포에만 존재한다.
Intracellular Ca2+ (Cai)이 감소하면 Vm이 탈분극 상태임에도 불구하고 ICaL이 불활성화 상태에서 부분적으로 회복될
수 있다. 이는 활동전위가 완전히 재분극 되기도 전에 ICaL이
reactivation되어 유발(trigger) 기전 중 하나인 early
afterdepolarization (EAD)을 유발할 수 있음을 의미한다.
정상 E-C coupling 동안에 ICaL을 통한 Ca2+의 유입은 SR
Ca2+ release (Ca2+ sparks)를 유발한다. local Ca2+이나
intra-SR Ca2+가 증가함에 따라 Ca2+ sparks가 일어날 가능성이 높고 SR Ca2+ load가 충분할 때 spontaneous SR
Ca2+ release가 발생하여 delayed afterdepolarization (DAD)을 야기한다.17
최근 optical mapping study와 같이 membrane
potential과 calcium dynamics를 동시에 기록할 수 있는
방법이 개발됨에 따라 제세동시 발생하는 calcium
dynamics의 변화를 관찰할 수 있게 되었고 calcium
dynamics가 제세동의 결과를 결정하는 중요 기전임이 밝혀졌다. 이들 연구에 의하면 배양된 심근세포에 전기충격을 가할
경우 Cai은 감소하였다.18 또한 심실세동 지속 시에는 Cai이 증가하였고 제세동 전기충격을 가하면
증가된 Cai이 다시 감소하였다. 이때 Cai의 감소가 충분하지 않으면 심실세동이 재발하였다.19
Voltage에 상관없이 spontaneous Ca2+ release가
선행하고 뒤따라서 nondriven electrical activity가 발현되는 reverse E-C coupling (prefluorescence) 소견 역시 전기충격 후에 간혹 관찰되는데20 이들 소견은 모두 calcium
dynamics가 제세동의 결과를 결정하는 중요 기전임을 시사한다.
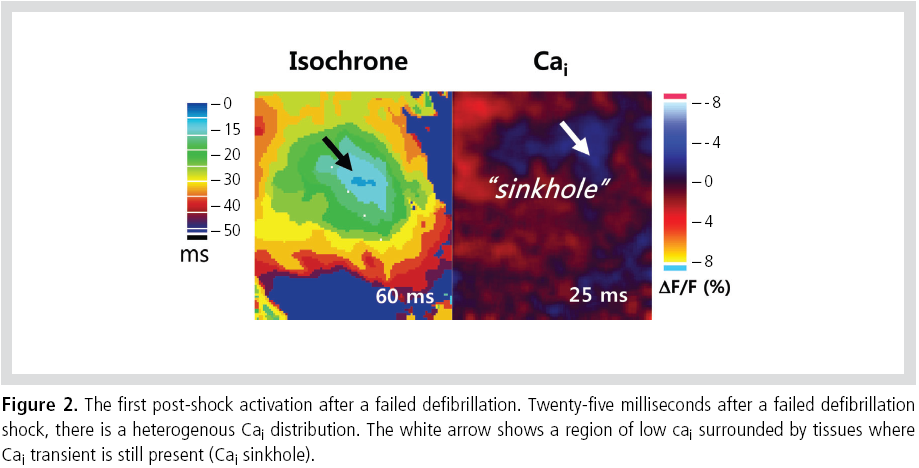
제세동이 실패한 경우 isoelectric window 기간 동안에
특이한 모양의 calcium dynamics를 관찰할 수 있는데 low
Cai area가 high Cai에 둘러싸인 양상이다(Figure 2). 이를‘Cai sinkhole' 이라 명명하였는데 제세동 후 심실세동이
재발할 때 발생하는 첫 electrical activation은 항상 Cai
sinkhole에서 발생하였다. Cai sinkhole은 전기충격을 취약기간에 가해(shock on T) 심실세동이 유발될 때도 관찰되었다.
전기충격 후 Cai sinkhole에서 focal activation이 유래하는 기전은 첫째, spontaneous (voltage-independent)
SR calcium release에 의한 reverse E-C coupling이다.
Cai sinkhole 내 low calcium은 주위조직에 비해 보다 SR
calcium uptake가 완성된 것을 의미하고 SR에 calcium이
많이 축적될수록 spontaneous calcium release가 일어나기 쉬운 상태가 된다. Spontaneous SR calcium release가 일어나면 DAD가 발생한다.
둘째, Cai sinkhole은 주위 조직에 비해 활동전위기간이 짧으므로 주위 high calcium
area로부터 electrotonic current가 Cai sinkhole로 유입
되면서 sinkhole내에서 impulse가 형성된다. 이 현상은 주위 세포간 활동전위기간의 차이에 의해 생기는 phase 2
reentry 혹은 reflection 현상과 비슷하다. 또한 ryanodine
receptor blocker인 ryanodine과 Ca ATPase inhibitor
인 thapsigargin을 투여하여 SR에서의 모든 calcium
transient를 차단하면 약물 투여 전에 비해 ULV와 DFT가 의미 있게 감소된다.21 이러한 소견 역시 calciumdynamics가 제세동과 vulnerability의 결과를 결정하는
주요 기전임을 시사한다.
결론
제세동의 기전을 밝히기 위해 지금까지 critical point 가설과 virtual electrode 가설, ULV가설과 연계하여 ‘triggered activity' 나 ‘progressive depolarization'
현상, 심근섬유방향의 비균질성, 칼슘 역학 등 여러 가설과
현상으로 설명하려는 시도가 있었고 연구의 획기적인 발전도 있었다. 하지만 제세동시 나타나는 모든 현상을 완벽하게 설명할 수 있는 이론은 아직까지 정립되지 못했다.
향후 실험기기의 비약적인 발전으로 이전에는 증명할 수 없었던
여러 현상들을 설명하는 것이 가능해 질 것이므로 조만간 제세동의
기전을 완벽하게 이해할 수 있게 되기를 기대해 본다.
References
- Wiggers CJ. Studies of ventricular fibrillationcaused by electric
shock. Cinematographic and electrocardiogrphic observations of
the natural process in the dog' s heart: Its inhibition by potassium
and the revival of coordinated beats by calcium.
Am Heart J.
1930;5:351-365.
- Worley SJ, Swain JL, Colavita PG, Smith WM, Ideker RE.
Development of an endocardial-epicardial gradient of activation
rate during electrically induced, sustained ventricular fibrillation
in the dog.
Chaos.
1985;55:813-820.
- Jalife J, Gray RA, Morley GE, Davidenko JM. Self-organization
and the dynamical nature of ventricular fibrillation.
Circulation.
1998;8:79-93.
- Huang J, Zhou X, Smith WM, Ideker RE. Restitution properties during ventricular fibrillation in the in situ swine heart.
Circulation.
2004;110:3167-3167.
- Ferris LP, King BG, Spence PW, Williams HB. Effect of electric shock on the heart.
Electr Eng.
1936; 55:498-515.
- Swerdlow C, Shivkumar K, Zhang J. Determination of the upper limit of vulnerability using implantable cardioverter-defibrillator electrograms.
Circulation.
2003;107:3028-3033.
- Battelli F. Le m 'ecanisme de la mort par les courants 'electriques chez l' homme.
Revue Med Suisse Romande.
1899;10:605-618.
- Chen PS, Shibata N, Dixon EG, Martin RO, Ideker RE. Comparison of the defibrillation threshold and the upper limit of ventricular vulnerability.
Circulation.
1986;73:1022-1028.
- Chen PS, feld GK, Kriett JM, Mower MM, Tarazi RY, Fleck RP, Swerdlow CD, Gang ES, Kass RM. Relation between upper limit of vulnerability and defibrillation threshold in humans.
Circulation.
1993;88:186-192.
- Winfree AT. Sudden cardia death: A problem in topology.
Sci Am.
1983; 248:144-149.
- Shibata N, Chen P-S, Dixon EG,Wolf PD, Danieley ND, Smith WM, Ideker RE. Influence of epicardial shock strength and timing on the induction of ventricular arrhythmias in dogs.
Am J Physiol.
1988;255:H891-H901.
- Efimov IR, Gray RA, Roth BJ. Virtual electrodes and deexcitation: New insights into fibrillation induction and defibrillation.
J Cardiovasc Electrophysiol.
2000;11(3):339-353.
- Chen P-S, Wolf PD, Melnick SD, Danieley ND, Smith WM, IdekerRE. Comparison of activation during ventricular fibrillation and following unsuccessful defibrillation shocks in open chest dogs.
Circ Res.
1990;66:1544-1560.
- Chen P-S, Wolf PD, Ideker RE. The mechanism of cardiac defibrillation: A different point of view.
Circulation.
1991; 84:913-919.
- Efimov I, Ripplinger C. Virtual electrode hypothesis of defibrillation.
Heart Rhythm.
2006; 3(9):1100-1102.
- Mazeh N, Roth BJ. A mechanism of the upper limit of vulnerability.
Heart Rhythm.
2009;6:361-367.
- Cheng h, Lederer MR, Lederer WJ, Cannell MB. Calcium sparks and [Ca2+] waves in cardiac myocytes.
Am J Physiol.
1996;270:C148-C159.
- Fast VG, Check ER, Pollard AE, Ideker RE. Effects of electrical shocks on Ca2+ and Vm in myosites cultures.
Circ Res.
2004;94:1589-1597.
- Zaugg CE, Wu ST, Barbosa V, Buser PT, Wikman-Coffelt J, Parmley WW, Lee RJ. Ventricular fibrillation-induced intracellular Ca2+ overload causes failed electrical defibrillation and post-shock reinitiation of fibrillation.
J Mol Cell Cardiol.
1998;30:2183-2192.
- Boyden PA, barbhaiya C, Lee T, Kers HE. Nonuniform Ca2+ transients in arrhythmogenic Purkinje cells that survive in the infarcted canine heart.
Cardiovasc Res. 2003;57:681-693.
2003;57:681-693.
- Hwang GS, hayashi H, Tang L, Ogawa M, Hernandez H, Tan Y, Li H, Karagueuzian HS, Weiss JN, Lin SF, Chen PS. Intracellular calcium and vulnerability to fibrillation and defibrillation in Langendorff perfused rabbit ventricles.
Circulation.
2006;114;2595-2603.
|
|
|
|